1、填空题 (12分)如图是常见原电池装置,电流表G发生偏转:

(1)若两个电极分别是Zn、Cu,电解质溶液是稀硫酸,正极的电极反应式为___________________________;如果把电解质溶液换成硫酸铜溶液,则正极的电极反应式为_____________________________。
(2)若总反应是2FeCl3+Fe=3FeCl2,则可以做负极材料的是________,
负极上发生的电极反应是________________________。
(3)若电解质溶液是稀硫酸,Mg、Al两种金属做电极,则Mg电极的电极反应式为_____________;
若电解质溶液换作稀氢氧化钠溶液,Mg、Al两金属做电极,则Mg是____(填“正极”或“负极”),总反应的离子方程式是_______________________________。
参考答案:(1)2H++2e-=H2↑,Cu2++2e-=Cu;(2)Fe,Fe-2e-=Fe2+;
(3)Mg-2e-=Mg2+ ,正极,2Al+2H2O+2OH-=2AlO2-+3H2↑。
本题解析:(1)根据原电池的工作原理,能与电解质溶液反应的,作原电池的负极,两者都反应的,活泼性强的作负极,锌作负极,铜作正极,H+在正极上得电子转变成氢气,电极反应式:2H++2e-=H2↑,如果换成硫酸铜溶液,正负两极不变,铜离子在正极上得电子,电极反应式:Cu2++2e-=Cu;(2)根据原电池工作原理,负极上化合价升高,被氧化,则Fe作负极,电极反应式:Fe-2e-=Fe2+;(3)两者都与稀硫酸反应,金属性强的作负极,Mg比Al活泼,Mg作负极,电极反应式:Mg-2e-=Mg2+ ,如果换成氢氧化钠溶液,铝与氢氧化钠反应,而镁不与反应,则铝作负极,镁作正极,铝与氢氧化钠溶液反应的离子方程式:2Al+2H2O+2OH-=2AlO2-+3H2↑。
考点:考查原电池的工作原理、形成条件。
本题难度:一般
2、选择题 如图为一原电池的结构示意图,下列说法中,不正确的是( )

A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.盐桥中阳离子流向CuSO4溶液中
参考答案:解;A.该原电池中,负极上锌失电子生成锌离子,正极上铜离子得到生成铜,电池反应式为:Zn+Cu2+=Zn2++Cu,故A正确;
B.该原电池中,易失电子的锌作负极,铜作正极,电子从锌沿导线流向铜,故B正确;
C.原电池工作时,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应,所以正极上有铜单质析出导致CuSO4溶液蓝色变浅,故C错误;
D.原电池工作时,阳离子向正极移动,故D正确.
故选C.
本题解析:
本题难度:一般
3、选择题 判断在下列装置中电流表能发生偏转的是(?)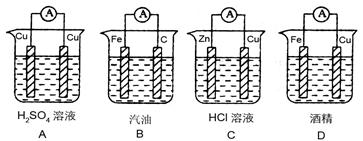
参考答案:C
本题解析:略
本题难度:简单
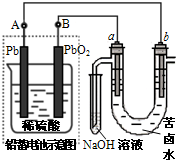
4、选择题 用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示?(a、b为石墨电极).下列说法中正确的是( )
A.铅蓄电池放电时,溶液的pH变小
B.铅蓄电池负极的反应式为:Pb-2e-+SO42-=PbSO4
C.铅蓄电池充电时,B极应与外电源负极相连
D.电解苦卤水时,电极首先放电的是H+