1、选择题 物质的量相同的甲烷和氨气,一定相同的是
A.质量
B.体积
C.分子数
D.原子数
参考答案:C
本题解析:分析:甲烷和氨气的相对分子质量不同,由于气体存在的条件未知,则不能确定气体的体积,根据N=nNA结合分子的构成确定微粒数目.
解答:A.甲烷和氨气的相对分子质量不同,则等物质的量的两种气体的质量不同,故A错误;
B.由于气体存在的条件未知,则不能确定气体的体积,故B错误;
C.根据N=nNA可知两种气体的分子数相等,故C正确;
D.构成两种分子的原子数目不同,分别为5和4,则相同物质的量时气体的原子数目不同,故D错误.
故选C.
点评:本题考查阿伏伽德罗定律及推论,题目难度不大,答题时注意审题,判断气体存在的体积以及分子构成,为解答该题的关键.
本题难度:困难
2、选择题 同温同压下,a?g甲气体和2a?g乙气体所占的体积之比为1:2,根据阿伏加德罗定律判断,下列叙述不正确的是
A.同温同压下甲和乙的密度之比为1:1
B.甲与乙的相对分子质量之比为1:1
C.同温同体积下等质量的甲和乙的压强之比为1:1
D.等质量的甲和乙中的原子数之比为1:1
参考答案:D
本题解析:分析:同温同压下,a?g甲气体和2a?g乙气体所占的体积之比为1:2,由n=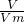 可知甲乙两种气体的物质的量之比为1:2,结合n=
可知甲乙两种气体的物质的量之比为1:2,结合n= 进行判断.
进行判断.
解答:A.同温同压下,气体摩尔体积相同,a?g甲气体和2a?g乙气体所占的体积之比为1:2,根据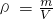 知,其密度相同,故A正确;
知,其密度相同,故A正确;
B.根据m=nM=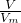 M知,二者的相对分子质量为1:1,故B正确;
M知,二者的相对分子质量为1:1,故B正确;
C.根据PV=nRT= 知,同温同体积下等质量的甲和乙的压强之比等于其摩尔质量的反比,因为二者摩尔质量相同,所以压强相同,故C正确;
知,同温同体积下等质量的甲和乙的压强之比等于其摩尔质量的反比,因为二者摩尔质量相同,所以压强相同,故C正确;
D.等质量的两种气体的物质的量相同,但分子的构成未知,所以无法判断原子个数是否相同,故D错误;
故选D.
点评:本题考查阿伏伽德罗定律及其推论的应用,侧重于气体的质量、密度等物理量的考查,题目难度不大,注意把握相关计算公式的运用.
本题难度:一般
3、选择题 下列溶液中Cl-的物质的量浓度与100mL,1mol/L?MgCl2溶液中Cl-的物质的量浓度相同的是
A.50mL?2mol/L?CaCl2溶液
B.100mL?2mol/L?NaCl溶液
C.50mL?4mol/L?CaCl2溶液
D.100mL?4mol/L?NaCl溶液
参考答案:B
本题解析:分析:1mol/LMgCl2溶液中Cl-的物质的量浓度为2mol/L,计算选项中氯离子的浓度,注意离子浓度与溶液体积无关,与电解质电离的离子数目有关,对于不发生水解的离子浓度=电解质浓度×电离出相应离子数目,据此进行判断.
解答:100mL?1mol?L-1?MgCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(MgCl2)=2mol/L,
A、50mL0.5mol?L-1CaCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(CaCl2)=1mol/L,故B错误;
B、100mL2mol?L-1NaCl溶液中Cl-的物质的量浓度C(Cl-)=C(NaCl)=2mol/L,故B正确;
C、50mL4mol?L-1CaCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(CaCl2)=8mol/L,故C错误;
D、100mL4mol?L-1NaCl溶液中Cl-的物质的量浓度C(Cl-)=C(NaCl)=4mol/L,故D错误;
故选B.
点评:本题考查离子浓度的计算,注意离子浓度与溶质浓度的关系即可解答,难度不大,注意与体积无关.
本题难度:困难
4、选择题 用NA表示阿伏加德罗常数的值.下列说法正确的是
A.标准状况下,22.4?L?H2O中含有的分子数为NA
B.28?g?N2中含有的分子数为NA
C.1?mol?Mg与足量稀盐酸反应转移的电子数为NA
D.1?L?1?mol?L-1?Na2?CO3溶液中含有的钠离子数为NA
参考答案:B
本题解析:分析:A、标准状况下,水是液体,无法求算物质的量;
B、28g氮气的物质的量是1mol,含有分子数是NA;
C、1mol镁反应失去2mol电子;
D、碳酸钠的物质的量是1mol,含有2mol钠.
解答:A、由于标况下,水不是气体,故无法计算其物质的量,故A错误;
B、氮气的摩尔质量是28g/mol,28g氮气的物质的量是1mol,含有的分子数为NA,故B正确;
C、1mol镁与足量盐酸反应,失去1mol电子,转移的电子数为2NA,故C错误;
D、该碳酸钠溶液中含有1mol碳酸钠,含有2mol钠离子,故含有的钠离子数为2NA,故D错误;
故选B.
点评:本题借助阿伏伽德罗常数,考查了有关物质的量的简单计算,注意物质的状态,本题难度中等.
本题难度:一般
5、选择题 设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.1?mol甲烷中的氢原子被氯原子完全取代,需要2?nA?Cl2
B.1.5?mol?NO2与足量H2O反应,转移的电子数为2nA
C.常温常压下,46?g的NO2和N2O4混合气体含有的原子数为3nA
D.常温常压下,mg乙烯与mg丙烯中均含有()nA对共用电子对
参考答案:CD
本题解析:分析:A、取代反应的特征是有出有进,有机化合物中的氢原子被其他原子或原子团代替发生的反应;1mol氢原子需要1molCl2取代;
B、根据化学方程式计算电子转移数;
C、二氧化氮和四氧化二氮的组成元素相同,原子个数比相同,所以只需要计算46gNO2中 所含原子数即可;
D、质量换算物质的量,结合分子结构计算共价键物质的量,形成一个共价键需要两个电子;
解答:A、1?mol甲烷中含有4mol氢原子,4molCl2提供4mol氯原子发生取代反应,被氯原子完全取代,需要4?nA?Cl2,故A错误;
B、NO2与足量H2O反应的化学方程式为:3NO2+H2O=2HNO3+NO,每3molNO2反应转移电子物质的量为2mol,所以1.5?mol?NO2与足量H2O反应,转移的电子数为nA,故B错误;
C、NO2和N2O4的最简比相同,只需计算46gNO2中所含原子物质的量即可,46?g的NO2和N2O4混合气体含有的原子数为=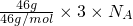 =3nA,故C正确;
=3nA,故C正确;
D、mg乙烯C2H4含有共价键即共用电子对物质的量=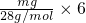 =
=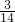 mol,mg丙烯C3H6中含有共价键即共用电子对物质的量=
mol,mg丙烯C3H6中含有共价键即共用电子对物质的量=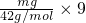 =
=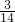 mol,所以,mg乙烯与mg丙烯中均含有(
mol,所以,mg乙烯与mg丙烯中均含有(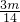 )nA对共用电子对,故D正确;
)nA对共用电子对,故D正确;
故选CD.
点评:本题考查了阿伏伽德罗常数的应用,氧化还原反应的电子转移数的计算,主要考查依据物质的量计算微粒数、共价键、共用电子对数的计算关系.
本题难度:困难