1、填空题 常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:

(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
参考答案:(11分) (1)MOH=M+ + OH-(若写可逆号扣1分)(2分)
(2)碱(1分) A- + H2O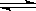 HA + OH-(2分) > (1分)
HA + OH-(2分) > (1分)
(3)[M+] = [A-]>[H+]=[OH-] (2分)
(4) = (2分) 0.05 + 10-11 (若只写0.05不得分)(2分)
本题解析:(1)根据图像可知,当加入13mlHA时,HA是过量的,但溶液显中性,这说明MOH一定是强碱,而HA是弱酸,则MOH在水溶液中的电离方程式为MOH=M+ + OH-。
(2)由于HA是弱酸,MOH是强碱,则MOH与HA恰好完全反应时,生成的MA水解,溶液呈碱性,水解方程式是A- + H2O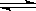 HA + OH-。HA是弱酸,抑制水的电离,而水解促进水的电离,所以混合溶液中由水电离出的c(H+)>0.2 mol/L HA溶液中由水电离出的c(H+)。
HA + OH-。HA是弱酸,抑制水的电离,而水解促进水的电离,所以混合溶液中由水电离出的c(H+)>0.2 mol/L HA溶液中由水电离出的c(H+)。
(3)B点溶液显中性,则根据电荷守恒可知[M+]=[A-]>[H+]=[OH-]。
(4)D点溶液中的溶质是MA和HA,且二者的浓度是相等的,所以根据物料守恒可知,c(A-)+c(HA)=2 c(M+)。有电荷守恒可知c(A-)+c(OH-)=c(M+)+c(H+),则c(HA) + c(H+)=c(OH-)+ c(M+)=10-11+0.05。
考点:考查弱电解质的电离、盐类水解、溶液中离子浓度大小比较和有关计算
点评:该题是中等难度的试题,试题贴近高考,综合性强,试题基础性强,侧重能力的培养和解题方法的指导,主要是考查学生分析和解决问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。该题的关键是明确溶液中离子的几种守恒关系,即电荷守恒、物料守恒及质子守恒。
本题难度:困难
2、填空题 硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中 随pH变化的关系:
随pH变化的关系:

| 91:9
| 1:1
| 9:91
|
室温下pH
| 8.2
| 7.2
| 6.2
|
(1)简述 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
c (HSO3-) + 2c (SO32-) =" _______" mol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式: 。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62-……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
参考答案:(1)HSO3-的电离程度与SO32-的水解程度相近(1分) 0.2 mol/L(2分)
(2)a c(2分)
(3)KHSO4 →K+ + HSO4- (1分)
(4)5K2S2O8 + 2MnSO4 + 8H2O→ 4K2SO4 + 2KMnO4 + 8H2SO4(2分)
(5)S2O82- > I2 > S4O62- (2分)
(6)CH3—CClF2(g) → CH2=CF2(g) + HCl(g)
本题解析:
本题难度:一般
3、选择题 下列电离或水解方程式正确的是
A.Na2SO3的水解:SO32-+ 2H2O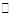 H2SO3 + 2OH-
H2SO3 + 2OH-
B.NaHCO3的电离:NaHCO3  Na + + H+ + CO32-
Na + + H+ + CO32-
C.KHS溶液中HS-的电离:HS-+ H2O  H3O+ + S2-
H3O+ + S2-
D.NaClO溶液与FeCl2溶液混合:2ClO- + Fe2+ + 2H2O =" 2HClO" + Fe(OH)2↓
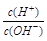 并依据水的离子积常数可知溶液中c(H+)=10-4mol/L,则pH=4,B正确;B、根据A中分析可知OA段醋酸过量溶液显酸性,但如果加入的氢氧化钠很少,则c(CH3COO-)<c(CH3COOH),C错误;D、若B点时加入NaOH溶液40 mL,则此时溶液是等物质的量浓度的醋酸钠和氢氧化钠的混合液,因此根据物料守恒c(CH3COO-)+c(CH3COOH)=2 c(Na+)和电荷守恒c(CH3COO-)+ c(OH-)=c(Na+) + c(H+) 可知所得溶液中:c(CH3COO-)+2c(CH3COOH) + c(H+)=c(OH-),D正确,答案选AC。
并依据水的离子积常数可知溶液中c(H+)=10-4mol/L,则pH=4,B正确;B、根据A中分析可知OA段醋酸过量溶液显酸性,但如果加入的氢氧化钠很少,则c(CH3COO-)<c(CH3COOH),C错误;D、若B点时加入NaOH溶液40 mL,则此时溶液是等物质的量浓度的醋酸钠和氢氧化钠的混合液,因此根据物料守恒c(CH3COO-)+c(CH3COOH)=2 c(Na+)和电荷守恒c(CH3COO-)+ c(OH-)=c(Na+) + c(H+) 可知所得溶液中:c(CH3COO-)+2c(CH3COOH) + c(H+)=c(OH-),D正确,答案选AC。