1、实验题 (12分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
气体
| a
| b
| c
| d
|
Cl2
| 浓盐酸
| MnO2
| NaOH溶液
| 浓H2SO4
|
NH3
| 饱和NH4Cl溶液
| 消石灰
| H2O
| 固体NaOH
|
NO
| 稀HNO3
| 铜屑
| H2O
| P2O5
|
(1)写出制取Cl2的化学方程式________________________。
写出制取NO的化学方程式________________________。
(2)上述方法中可以得到干燥、纯净的气体是?。
(3)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体?,理由是?。
②气体?,理由是?。
③气体?,理由是?。
参考答案:(1) MnO2 + 4HCl(浓)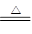 MnCl2 + Cl2↑+ 2H2O?
MnCl2 + Cl2↑+ 2H2O?
3Cu + 8HNO3=3Cu(NO3)2 + 2NO↑+4H2O
(2) NO? (3)?①Cl2?反应生成的Cl2被c中的NaOH溶液吸收了
②NH3?反应生成的NH3被c中的H2O吸收了
本题解析:(1)实验室制取氯气和NO的方程式分别是MnO2 + 4HCl(浓)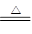 MnCl2 + Cl2↑+ 2H2O、3Cu + 8HNO3=3Cu(NO3)2 + 2NO↑+4H2O。
MnCl2 + Cl2↑+ 2H2O、3Cu + 8HNO3=3Cu(NO3)2 + 2NO↑+4H2O。
(2)氯气能溶于氢氧化钠溶液,氨气极易溶于水,NO不溶于水,所以可以得到干燥、纯净的气体是NO。
(3)①氯气能和氢氧化钠溶液反应,反应生成的Cl2被c中的NaOH溶液吸收了,所以得不到氯气。
②氨气极易溶于水,反应生成的NH3被c中的H2O吸收了,所以得不到氨气。
本题难度:一般
2、选择题 (2011·广东六校模拟)用下图装置进行实验,下表中实验结果能说明结论的是( )
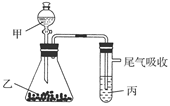
?
| 甲
| 乙
| 丙
| 结论
|
A
| 水
| 电石
| 溴水
| 稳定性:水>C2H2>Br2
|
B
| 盐酸
| 石灰石
| 苯酚钠溶液
| 酸性:HCl>H2CO3>苯酚
|
C
| 盐酸
| FeS
| 溴水
| 还原性:S2->Br->Cl-
|
D
| 浓盐酸
| KMnO4
| KBr溶液
| 氧化性:KMnO4<Cl2<Br2
|
?
参考答案:B
本题解析:物质之间发生反应,无法确定彼此稳定性的大小,A项错误;B项中发生的反应有:CaCO3+2HCl===CaCl2+H2O+CO2↑,C6H5ONa+H2O+CO2―→C6H5OH+NaHCO3,它们都属于酸与盐之间的复分解反应,符合强酸制弱酸的规律,可以说明酸性规律:HCl>H2CO3>苯酚,B项正确;C项中FeS+2HCl===FeCl2+H2S↑是非氧化还原反应,据此无法确定S2-、Cl-的还原性强弱,C项错误;D项中反应2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,Cl2+2KBr===2KCl+Br2均为氧化还原反应,根据氧化性强弱规律可确定氧化性的强弱顺序为KMnO4>Cl2>Br2,D项错误。
本题难度:一般
3、选择题 除去Cl2中混有的少量HCl气体,可将气体通入
A.苛性钠溶液
B.饱和NaHCO3溶液
C.澄清石灰水
D.饱和氯化钠溶液
参考答案:D
本题解析:A中的氢氧化钠、B中的碳酸氢钠、C中的澄清石灰水均能和氯气反应,随意不能用来除去氯气中的氯化氢气体。氯化氢极易溶于水,所以可用于饱和食盐水来除去氯气中的氯化氢气体,答案选D。
点评:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:简单
4、选择题 下列方法中,不能用于实验室制取氨气的是
A.将烧瓶中的浓氨水加热
B.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
C.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
D.加热试管中的氯化铵固体
参考答案:D
本题解析:D.加热试管中的氯化铵固体,生成的HCl和NH3在管口又反应生成氯化铵固体。
本题难度:一般
5、实验题 (每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品?(填字母编号)
B、0.5L平底烧瓶? C、0.5L容量瓶? D、0.5L圆底烧瓶? E、烧杯? F、试管? G、胶头滴管? H、量筒? I、托盘天平? J、药匙? M、滤纸? N、玻璃棒
(2)应称取?g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入?(酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据?判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据?判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=?
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温 度升高的平均值为3.41℃,则实验测得中和热△H=?(混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论?(偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H=?(混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论?(偏高,相等,偏低)
参考答案:(每空2分 ,?共14分)
(一)(1)CHENG?(2)10.6
(二)(1)碱式?黄色变成橙色30s不褪去
(2)0.5mol/L
(三)- 57.0 KJ/mol?偏高
本题解析:略
本题难度:简单