|
高考化学试题《气体的净化、干燥、吸收与收集》在线测试(2019年最新版)(八)
2019-07-04 00:25:20
【 大 中 小】
|
1、实验题 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
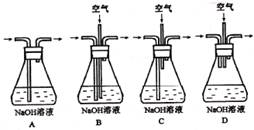
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:_?;为了吸收该反应中产生的尾气,应选择下列装置(填字母)。
(2)为符合绿色化学的要求,某研究性学习小组设计了如下两种方案:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧 化铜与稀硫酸反应。
方案2:将空气或氧气直接通人到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp(Cu(OH)2]=10-22, Ksp[Fe(OH)2]=10-16,Ksp[Fe(OH)3]=10-38
请回答下列问题:
①方案1中的B仪器名称是_。
②为了使铁元素全部沉淀,应调节pH至少为_。
③方案2中甲物质可选用的是_。
A.CaO
B.NaOH
C.CuCO3
D.Cu2(OH)2CO3 E. Fe2(SO4)3
| ④反应中加人少量FeSO4可加速铜的氧化,用离子方程式解释其原因?、
?
参考答案:(1)3:2;B。
(2)①坩埚;②3;③CD。-
④4Fe2++O2+4H+=4Fe3++2H2O;2Fe3++Cu=2Fe2++Cu2+;
本题解析:试题分析:(1)由题意书写化学方程式3Cu+2HNO3-+3H2SO4=3CuSO4+2NO↑+4H2O,因此H2SO4和HNO3物质的量之比为3:2; (2)①灼烧需要在坩埚中进行②假设c(Fe3+)=10-5mol·L-1由Ksp[Fe(OH)3]=10-38计算得c(OH-)=10-11mol·L-1,即pH值为11;③加入的物质需要能够消耗H+同时又不引入新的杂质;(4)(参照答案)。
本题难度:一般
2、填空题 (10分)榴石矿石可以看作 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下: 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
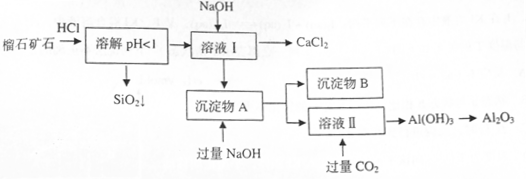
(1)榴石矿加盐酸溶解后,溶液里除了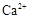 外,还含有的金属离子是?。 外,还含有的金属离子是?。
(2)对溶液I进行操作时,控制溶液PH=9~10(有关氢氧化物沉淀的PH见下表)
NaOH不能过量,若NaOH过量可能会导致?溶解,?沉淀。

(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式?。
(4)①某同学在实验室中用图I装置制取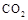 气体并通入溶液II中,结果没有沉淀产生,可能的原是?;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为?。 气体并通入溶液II中,结果没有沉淀产生,可能的原是?;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为?。
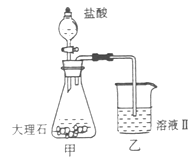
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系?。
参考答案:(10分)
(1)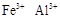 (2分) (2分)
(2)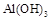 ?(1分)? ?(1分)?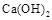 ?(1分) ?(1分)
(3)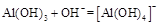 ?(2分) ?(2分)
(4)①盐酸挥发,制取的二氧化碳中含有盐酸(1分)?在甲与乙之间加一盛有饱和碳酸氢钠溶液的洗气瓶(1分)? ②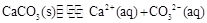 (2分) (2分)
本题解析:(1)榴石矿加盐酸后溶液中金属离子有:Ca2+、Fe3+、AL3+,SiO2不溶于盐酸;
(2)向溶液I中加入NaOH溶液,NaOH不能过量,若NaOH过量可能会导致AL(OH)3溶解,氢氧化铝为典型的两性氢氧化物,同时可能会生成Ca(OH)2沉淀。控制溶液PH=9~10的目的是使Fe3+、AL3+变为沉淀,而Ca2+则不能生成沉淀。
(3)写出向沉淀物A中加入过量氢氧化钠溶液,其中氢氧化铝会与氢氧化钠溶液反应,而氢氧化铁沉淀则不溶于氢氧化钠溶液。其反应的离子方程式为: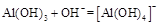 或AL(OH)3+OH—=ALO2—+2H2O; 或AL(OH)3+OH—=ALO2—+2H2O;
(4)①大理石与稀盐酸反应生成的二氧化碳气体中混有HCL、水蒸气等杂质气体,要使澄清石灰水能变浑浊只需将二氧化碳气体中的HCL气体除去,可将混合气体通入盛有饱和碳酸氢钠的洗气瓶中。
②石灰水变浑浊是生成了碳酸钙,其溶解平衡表达式为:CaCO3(s)?Ca2+(aq)+2OH—(aq)
本题难度:简单
3、选择题 下列每组物质只用水就能鉴别的一组是( )
A.苯、乙醇、四氯化碳
B.乙醇、乙醛、溴乙烷
C.乙醛、丙醇、硝基苯
D.硝基苯、乙醇、甘油
参考答案:A
本题解析:只用水就能鉴别,说明利用的是物质的溶解性。苯、四氯化碳、溴乙烷、硝基苯都是不溶于水的,其中苯的密度小于水的,而其余都是大于水的。乙醇、乙醛、丙醇和甘油都是和水互溶或易溶的,所以答案选A。
本题难度:简单
4、选择题 下列关于各实验装置的叙述正确的是( )

A.装置①可用于收集C2H4、HCl、SO2等气体
B.装置②可用于干燥、收集氯化氢,并吸收多余的氯化氢
C.装置③可用于吸收NH3、SO2、HCl等气体,并防止倒吸
D.装置④可用于检查该装置的气密性
参考答案:A、装置①收集气体时采用的是排空气法,要求所收集气体的密度要与空气的密度有一定的差距,乙烯的密度与空气接近,不能用该装置收集,故A错误;
B、碱石灰具有碱性,只能干燥碱性或中性气体,不能干燥酸性气体,氯化氢是酸性气体,所以不能用碱石灰干燥;收集HCl气体时,应该是长导管进气,短导管出气,故B错误;
C、装置③下层为CCl4,NH3或HCl、SO2易溶于水且不溶于CCl4的气体,可以用装置③并可防倒吸,故C正确;
D、装置④通过移动左管使两管液面相平,常用测量气体的体积,不能检查装置的气密性,故D错误;
故选C.
本题解析:
本题难度:简单
5、实验题 以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH)。
已知两个醛分子在一定条件下可以自身加成。下式中反应物的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得。(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):
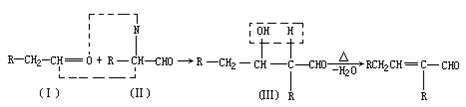
请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方程式(不必写出反应条件)____。
参考答案:①CH2==CH2+H2O→CH3CH2OH,
②2CH3CH2OH+O2→2CH3CHO+2H2O,

⑤CH3CH==CH—CHO+2H2→CH3CH2CH2CH2OH,其中①、②可合写成2CH2==CH2+O2→2CH3CHO,③、④可合写成CH3CHO+CH3CHO→CH3CH=CH—CHO+H2O
本题解析:先分析合成过程中的碳原子变化:由乙烯的2个碳原子变成正丁醇的4个碳原子,必有有机物之间的加成反应,由信息知乙醛自身加成生成有4个碳原子的有机物,所以可确定其合成路线:CH2=CH2→CH3CHO→CH3CH=CH—CHO→CH3CH2CH2CH2OH。
本题难度:一般
|