1、选择题 光纤和某一种玻璃的主要成分都可看成是SiO2,则
[? ]
A.前者是晶体,后者是非晶体
B.两者都是非晶体
C.两者都是晶体
D.后者是晶体,前者是非晶体
参考答案:A
本题解析:
本题难度:简单
2、填空题 (7分))如图是氯化钠的晶胞示意图,回答如下问题:
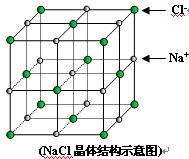
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
A.正四面体? B.正六面体? C.正八面体? D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒? B.烧杯? C.容量瓶? D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
参考答案:(1)C(1分)?(2) (NaCl)2(写成Na2Cl2也可以)(3)C?(4) 58.5V/(2ab3)每空2分
本题解析:略
本题难度:简单
3、选择题 关于CO2说法正确的是
A.碳原子采取sp杂化
B.CO2是正四面体型结构
C.干冰是原子晶体
D.CO2为极性分子
参考答案:A
本题解析:
正确答案:A,碳形成两个δ键,两个∏键;B为直线型;C为分子晶体;D为非极性分子
本题难度:一般
4、选择题 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和SiO2
B.NaCl和HCl
C.CCl4和KCl
D.NH3和H2O
参考答案:D
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。据此可知,A中前者是含有共价键的分子晶体,后者是含有共价键的原子晶体;B中前者是含有离子键的离子晶体,后者是含有共价键的分子晶体;C中前者是含有共价键的分子晶体,后者是含有离子键的离子晶体;D中都是含有共价键的分子晶体,D正确,答案选D。
点评:该题是高考中的常见题型和重要的考点,试题基础性强,贴近高考,旨在培养学生分析、归纳和总结问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。该题的关键是明确化学键和晶体类型的含义、判断依据,然后结合题意灵活运用即可。
本题难度:简单
5、选择题 下列说法正确的是?(?)
A.含有金属阳离子的晶体一定是离子晶体
B.原子晶体中,粒子之间只有一种作用力,即共价键
C.分子晶体中,粒子之间均有两种作用力,即范德华力和共价键
D.金属晶体的性质,都可以用电子气理论来解释
参考答案:B
本题解析:A错,如金属晶体由金属阳离子和自由电子构成;B正确;C错,如稀有气体晶体,只存在分子间作用力;D错,金属晶体的性质,有些可用电子气理论来解释;
本题难度:一般