1、选择题 最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是
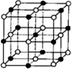
A.Ti14C13
B.Ti13C14
C.Ti6C7
D.TiC
参考答案:A
本题解析:由于该结构为“气态团簇分子”,给出的结构就是一个“完整”的分子,因此结构中的每个原子都是构成分子的一部分。由于该“气态团簇分子”结构含有14个Ti和13个C,于是该物质的化学式为Ti14C13。故选A。
点评:本题考查了根据晶胞结构确定化学式,难度不大,利用均摊法即可分析解答本题。
本题难度:一般
2、填空题 硫化氢(H2S)分子中,两个H-S键的夹角接近90°,说明H2S分子的空间构型为__________;二氧化碳(CO2)分子中,两个C=O键的夹角是180°,说明CO2分子的空间构型为___________;甲烷(CH4)分子中,两个相邻C-H键的夹角是109°28′,说明CH4分子的空间构型为____________。
参考答案:V形;直线型;正四面体
本题解析:
本题难度:一般
3、填空题 立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐___________,比较下列原子的第一电离能:Be___B,N___O(填“>”“<”),其原因是___________________。
(2)下图为立方氮化硼的晶胞,则氮化硼的化学式为_____________,该晶体中B原子填充N原子的_____________空隙。若该晶胞的边长为a cm,那么该晶体的密度为__________g/cm3(只要求列出算式)。
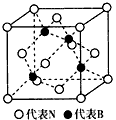
(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因:________________________。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为__________。请画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每 种原子不少于7个)___________________。
参考答案:(1)增大;>;>;Be原子中2s轨道处于全充满状态,N原子中2p轨道处于半充满状态,是比较稳定的状态,故它们的第一电离能高于两边相邻的原子
(2)BN;四面体;99.2/(a3NA)
(3)立方氮化硼晶体中氮硼键的键长比金刚石晶体中碳碳键的键长要长,故熔点比金刚石的低(4)sp2;
本题解析:
本题难度:一般
4、选择题 下列关于晶体的叙述中,不正确的是……( )
A.金刚石网状结构中,由共价键形成的碳原子环其中最小环有6个碳原子
B.在氯化钠的晶体中,每个Na+或Cl-的周围都紧邻6个Cl-或Na+
C.在氯化铯晶体中,每个Cs+周围都紧邻8个Cl-,每个Cl-周围也紧邻8个Cs+
D.在干冰的晶体中,每个CO2分子周围都紧邻4个CO2分子
参考答案:D
本题解析:从二氧化碳的基本结构可以知道,若以其中一个为中心,与其紧邻的二氧化碳分子有12个(3×8÷2=12),且相距均为边长的二分之根下二倍。
本题难度:一般
5、选择题 下面有关晶体的叙述中,正确的是(?)
A.分子晶体中一定存在共价键
B.第ⅦA族氢化物随相对分子质量增加,熔沸点逐渐升高,HF沸点最低
C.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏
D.熔融状态下导电的晶体一定是金属晶体
参考答案:C
本题解析:稀有气体原子的最外层电子已经达到稳定结构,所以稀有气体形成的分子中没有化学键,A不正确。氟化氢中存在氢键,其沸点最高,B不正确。离子晶体是靠离子键形成的,分子晶体是通过分子间作用力形成,所以选项C正确。D中也可以是离子晶体,不正确。答案选C。
本题难度:一般