1、推断题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的名称.A_________,D___________, E__________。
(2)A、B、C、D、E、F所形成的简单离子的半径由大到小的顺序是_________________。
(3)D、E、F对应的气态氢化物的稳定性顺序为_____________。
(4)B的单质在F的单质中反应的现象是___________,化学方程式为_________________。
(5)A、C两种元素最高价氧化物对应水化物反应的离子方程式为__________________。
参考答案:(1)钠;硅;磷
(2)Si4->p3->Cl->Na+>Mg2+>Al3+
(3)HCl>PH3>SiH4
(4)产生白色的烟;Mg+Cl2 MgCl2
MgCl2
(5)OH-+Al(OH)3=AlO2-+2H2O
本题解析:
本题难度:一般
2、选择题 下列各元素中一定属于主族元素的是
[? ]
A.X元素能形成+7价的含氧酸及其盐
B.Y元素的原子最外层有2个电子
C.Z元素的原子最外层电子数等于6
D.R元素的原子次外层有18个电子
参考答案:C
本题解析:
本题难度:简单
3、选择题 1869年,门捷列夫把已经发现的几十种元素按照相对原子质量的大小排成一行,又按照性质的相似性排列一列,终于制成了一个表,这就是最初的著名的元素周期表.在此基础上经过对比研究,他又成功地预测了当时尚未发现的几种元素并很快得到了实验的证实,轰动了化学界.根据以上所说,你认为下列说法不正确的是
A.门捷列夫在研究中运用了分类的方法
B.门捷列夫在研究中运用了比较和预测的方法
C.实验对门捷列夫的研究仍然具有重大意义
D.相对原子质量等于原子序数
参考答案:D
本题解析:门捷列夫在研究中充分运用了分类法、比较法和预测法.门捷列夫虽然没有运用实验的方法研究元素周期表,但每一种元素的发现和相对原子质量的测定等,都需要实验,而且他的预测只有经过实验证实才能得到验证.所以实验对于门捷列夫同样重要.D项是错误的说法.相对原子质量的大小不等于原子序数,原子序数等于元素的核电荷数.
本题难度:简单
4、填空题 下表是元素周期表的一部分,针对表中的(1)~(10)中元素,用元素符号、名称或化学式填空
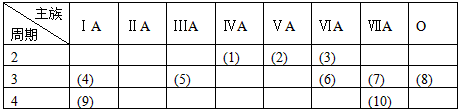
A、在这些元素中,化学性质最不活泼的是____________,这种原子的原子结构示意图____________;
B、用电子式表示(7)元素的单质分子的形成过程_____________________;
C、在非金属元素的最高价氧化物对应的水化物中酸性最强的是____________,在金属元素氧化物对应的水化物中,碱性最强的是____________;具有两性的化合物是____________。
D、地壳中含量最多的元素是____________,空气中含量最多元素是____________,常温下呈液态的非金属是____________。
E、元素(3)的氢化物与元素(7)的单质反应的离子方程式是______________________。
F、元素(4)最高价氧化物的水化物与元素(7)的最高氧化物的水化物反应的离子方程式________________________。
参考答案:A、Ar;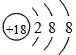
B、“略”
C、HClO4;KOH;Al(OH)3
D、O;N;Br
E、H2O+Cl2====H++ Cl-+HClO
F、H++OH-=== H2O
本题解析:
本题难度:一般
5、填空题 A,B,C是相邻的3种元素,A,B同周期,B,C同主族,且3种元素的质子数总和为30,写出这3种元素的名称_________________________
参考答案:A为镁,B为铝,C为硼(或A为氧,B为氮,C 为磷)
本题解析:
本题难度:一般