|
|
|
高考化学知识点总结《电解质和非电解质》考点特训(2019年冲刺版)(四)
2019-07-04 00:30:01
【 大 中 小】
|
1、填空题 下列物质属于电解质的是 ;能导电的物质是 。
①氨水 ②蔗糖 ③烧碱 ④NH3·H2O ⑤CO2 ⑥铜
参考答案:③④ ①⑥
本题解析:根据在水溶液或熔化状态下能否导电将化合物分为电解质和非电解质。识别注意两个要点:①必须为化合物②电解质包括的物质类别:酸、碱、盐、水、活泼金属氧化物。烧碱、NH3·H2O为碱,属于电解质;物质能否导电看其是否含有自由移动的带电微粒,铜中含有自由电子,氨水含有自由移动的NH4+和OH-,可以导电。
考点:考查电解质的概念及识别、物质的导电性判断。
本题难度:一般
2、填空题 ①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp [Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HA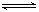 H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5 H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
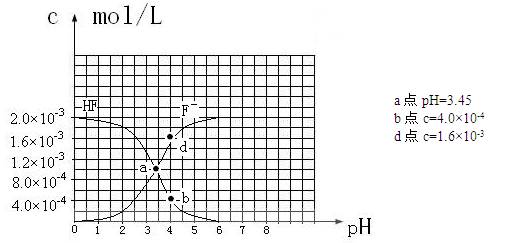
请根据以上信息回答下列问题:
(1)25℃时,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 。
(2)25℃时,HF电离常数的数值Ka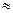 ,列式并说明得出该常数的理由 。 ,列式并说明得出该常数的理由 。
(3)25℃时,向浓度均为0.1 mol·L-1的相同体积的HF和醋酸两种溶液中分别加入相同的足量锌粒,初始时产生氢气的速率关系为 (填“>”“=”或“<”,下同)。反应结束后,产生氢气的物质的量的关系为 ,两溶液中c (F-) c (CH3COO-)。
(4)25℃时,4.0×10-3mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
参考答案:(1)Cu(OH)2(2分), Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+(2分)
(2)Ka=0.4×10-3或10-3.45。(3分)
HF电离平衡常数Ka= 【c(H+)c(F-)】/ c(HF),其中c(H+)、c(F-)、c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:PH=4时,c(H+)=10-4,c(F-)=1.6×10-3、c(HF)=4.0×10-4, Ka=0.4×10-3。(或根据a点数据c(H+)=10-3.45 、c(F-)=c(HF)得Ka= 10-3.45)(2分)
(3)>,= ,>(3分)
(4)PH=4.0,则c(H+)=10-4,此时:根据HF电离产生的c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。c 2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Ksp(CaF2)= ,此时有少量沉淀产生。(3分) ,此时有少量沉淀产生。(3分)
本题解析:略
本题难度:一般
3、选择题 以下表示的是碳及其化合物的相互转化关系:
C CO2 CO2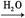 H2CO3 H2CO3 CaCO3 CaCO3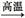 CO2 CO2
其中涉及的基本反应类型依次为 ( )
A.置换、化合、分解、复分解
B.置换、化合、复分解、分解
C.化合、置换、分解、复分解
D.化合、置换、复分解、分解
|
参考答案:B
本题解析: C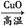 CO2为置换反应,CO2 CO2为置换反应,CO2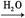 H2CO3为化合反应,H2CO3 H2CO3为化合反应,H2CO3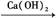 CaCO3为复分解反应,CaCO3 CaCO3为复分解反应,CaCO3 CO2为分解反应。 CO2为分解反应。
考点:化学反应类型
本题难度:一般
4、选择题 下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4
B.铝、二氧化碳
C.硫酸、蔗糖
D.熔融KNO3、氨水
|
参考答案:C
本题解析:A、NaCl晶体、BaSO4都是电解质,错误;B、Al不是电解质也不是非电解质,二氧化氮是非电解质,错误;C、硫酸是电解质,蔗糖是非电解质,正确;D、熔融硝酸钾是电解质,氨水是非电解质溶液,错误,答案选C。
考点:考查电解质、非电解质的判断
本题难度:一般
5、填空题 (22分)现有下列九种物质:
①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-
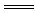
H2O,该离子反应对应的化学方程式为
。
(3)⑨在水中的电离方程式为
,
34.2g⑨溶于水配成250mL溶液, SO42-的物质的量浓度为
。
(4)少量的④通入⑥的溶液中反应的离子方程式为:
。
(5)将②加入NaOH的溶液中反应的离子方程式
(6)②与⑧发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是
(填化学式),还原剂与氧化剂的物质的量之比是
,当有5.4g Al发生反应时,转移电子的物质的量为
。
参考答案:19.(1) ②⑦⑧⑨ ④ ③⑤⑥⑨;(2)Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)Al2(SO4)3= 2Al3++3SO42- , 1.2mol/L
(4)Ba2++2OH-+CO2=BaCO3↓+H2O (5 ) 2Al+2OH-+2H2O=2AlO2-+3H2 ↑
(6)HNO3 1
本题解析:
本题难度:一般
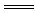 H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。