1、选择题 下列说法正确的是
A.铝是金属,与强碱不能发生反应
B.Na、Mg、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
C.将混有少量SO2的二氧化碳气体通入饱和NaHCO3溶液,可达到除杂的目的
D.过量的铜与浓硝酸反应,生成的气体只有NO2
参考答案:C
本题解析:铝是金属,但它既能与盐酸反应放出氢气,又能与NaOH等强碱溶液反应放出氢气,故A错误;Na与H2O剧烈反应,生成NaOH和H2,Mg与沸水迅速反应,生成Mg(OH)2和H2,Fe与水蒸气在加热时可以反应,生成Fe3O4和H2,Fe3O4是碱性氧化物,而不是碱,故B正确;SO2+H2O=H2SO3,亚硫酸的酸性比碳酸强,根据复分解反应发生的条件,则SO2+2NaHCO3=Na2SO3+CO2↑+H2O,因此能除去SO2,还能增加CO2,故C正确;铜与浓硝酸反应放出NO2气体,随着反应的进行,硝酸既被消耗,又被生成的水稀释,浓硝酸变为稀硝酸,铜与稀硝酸反应放出NO气体,因此反应生成的气体是 NO2、NO的混合气体,故D错误。
本题难度:简单
2、选择题 铜有两种常见的氧化物:CuO和Cu2O。某学习小组取0.98 g Cu(OH)2 固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示;
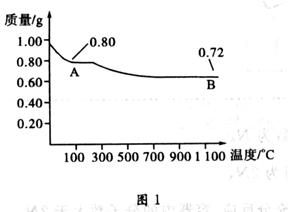
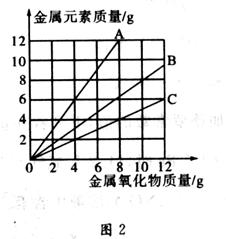
则下列分析正确的是(?)
A.图1中产物A、B的化学式分别为Cu2O和CuO?
B.图1整个过程中共生成0.26g水
C.图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是C?
D.图1中,A到B过程中有0.01 mol电子发生了转移
参考答案:D
本题解析:0.98gCu(OH)2质量减少为0.8g发生的反应为Cu(OH)2 CuO+H2O,0.8gCuO质量减少为0.72g,反应为4CuO
CuO+H2O,0.8gCuO质量减少为0.72g,反应为4CuO 2Cu2O+O2↑A、图1中产物A、B的化学式分别为CuO和Cu2O,错误;B、生成0.18gH2O,错误;C、图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是B,错误; D、由4CuO
2Cu2O+O2↑A、图1中产物A、B的化学式分别为CuO和Cu2O,错误;B、生成0.18gH2O,错误;C、图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是B,错误; D、由4CuO 2Cu2O+O2↑可知:共转移了0.01 mol电子,正确。
2Cu2O+O2↑可知:共转移了0.01 mol电子,正确。
本题难度:一般
3、选择题 将Fe、Cu?的混合物投入含有Fe3+、Cu2+、Fe2+的溶液中,反应后有铁剩余,则容器内还应存在的微粒是( )
A.Fe2+、Cu
B.Fe3+、Fe2+
C.Cu、Fe3+
D.Cu、Cu2+
参考答案:铁粉有剩余,根据反应顺序判断:氯化铁、氯化铜已全部反应,铜未反应,溶液中只有氯化亚铁,即溶液中只有
Fe2+,则容器中存在的微粒:铁、铜、Fe2+,故选:A.
本题解析:
本题难度:一般
4、选择题 在三氯化铁和氯化铜的混合液中加入过量铁粉,完全反应后,剩余的固体的质量与所加铁粉的质量相等。混合溶液中三氯化铁与氯化铜的物质的量之比为
A.1:3
B.2:7
C.2:3
D.2:1
参考答案:B
本题解析:略
本题难度:一般
5、简答题 氯化铁能腐蚀铜(2FeCl3+Cu=2FeCl2+CuCl2),工业上常用此原理生产印刷线路板(步骤Ⅰ).从废液中回收铜并得到FeCl3溶液循环利用的主要流程如下:
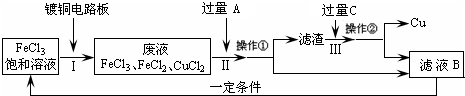
(1)写出步骤Ⅱ中发生反应的离子方程式______.
(2)试剂C是(填名称)______.
(3)若在实验室中完成上述流程,操作①中属于______操作(填名称).
(4)在步骤Ⅲ中加入过量C溶液的目的是______.
参考答案:(1)步骤Ⅱ是加入过量铁和氯化铁、氯化铜反应,最终得到氯化亚铁溶液、铁和铜,发生的反应的离子方程式为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
故答案为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)试剂C是溶解固体滤渣中的铁,得到的滤液B循环使用,试剂C为盐酸,故答案为:盐酸;
(3)操作①是分离溶液和固体,用过滤的方法分离,故答案为:过滤;
(4)在步骤Ⅲ中加入过量C溶液的目的是溶解滤渣中的铁生成氯化亚铁溶液,循环使用,故答案为:溶解滤渣中的铁生成氯化亚铁溶液,循环使用.
本题解析:
本题难度:一般