1、计算题 某链烃3.6g和Cl2发生取代反应,控制反应条件使其仅生成一氯代物,将反应生成的气体(一氯代物为液体)用NaOH溶液吸收恰好和0.1mol·L-1 NaOH溶液500mL完全反应,试解答下列问题:
(1)求该烃的相对分子质量;
(2)若该烃既不能使酸性KMnO4溶液褪色,又不能使溴水褪色,试求该烃的分子式。
(3)若该烃的一氯代物只有一种,试确定该烃的结构简式 (要求写出计算过程)。
参考答案:(7分)(1)72 (2分)(2)C5H12 ?(2分)(3) C(CH3)4 (3分)
本题解析:(1)消耗氢氧化钠的物质的量是0.1mol/L×0.5L=0.05mol,根据反应式NaOH+HCl=NaCl+H2O可知,生成的氯化氢是0.05mol。由于生成的是一氯代物,所以该烃的物质的量是0.05mol,则该烃的相对分子质量是3.6g÷0.05mol=72。
(2)若该烃既不能使酸性KMnO4溶液褪色,又不能使溴水褪色,说明不是烯烃。由于72÷14=5……2,因此是烷烃,化学式是C5H12。
(3)若该烃的一氯代物只有一种,这说明分子的氢原子完全是相同的,因此应该是新戊烷,结构简式是C(CH3)4。
点评:该题是中等难度的试题,侧重对学生基础知识的巩固和训练,明确有关的反应的原理以及常见烃分子的组成特点是答题的关键,有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:一般
2、实验题 (14分)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):
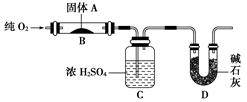
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
参考答案:(1)使有机物A充分燃烧
(2)吸收A燃烧后生成的H2O ?吸收A燃烧后生成的CO2
(3)能? (4)C12H22O11
(5)C12H22O11+12O2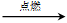 12CO2+11H2O
12CO2+11H2O
(6)C12H22O11(蔗糖)+H2O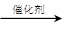 C6H12O6(葡萄糖)+C6H12O6(果糖)
C6H12O6(葡萄糖)+C6H12O6(果糖)
本题解析:(1)通入过量O2可以使有机物A充分燃烧,防止生成CO。
(2)浓硫酸具有吸水性,所以C装置的作用是吸收A燃烧后生成的H2O;碱石灰可以吸收CO2,所以D装置的主要作用是吸收A燃烧后生成的CO2。
(3)根据原子守恒可知和质量守恒定律可以判断出有机物中是否含有氧原子。
(4)根据题意A的物质的量是17.1g÷342 g/mol=0.05mol。水蒸气的物质的量是9.99g÷18g/mol=0.55mol,CO2的物质的量是26.4g÷44gmol=0.6mol。所以有机物中含有的碳、氢原子数目分别是0.6÷0.05=12、0.55×2÷0.05=22。所以含有的氧原子数目是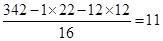 ,即A的分子式是C12H22O11。
,即A的分子式是C12H22O11。
(5)A燃烧的生成物是水和CO2,所以燃烧的化学方程式是C12H22O11+12O2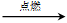 12CO2+11H2O。
12CO2+11H2O。
(6)1 mol A可水解生成2 mol同分异构体,则根据A的分子式可知,A是蔗糖,水解生成葡萄糖和果糖,化学方程式是C12H22O11(蔗糖)+H2O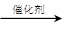 C6H12O6(葡萄糖)+C6H12O6(果糖)。
C6H12O6(葡萄糖)+C6H12O6(果糖)。
点评:在根据有机物燃烧的有关计算,特别是在判断是否含有氧原子时,需要依据原子守恒和质量守恒定律等进行列式解答,。其次还需要搞清楚哪些试剂是吸水的,哪些试剂是吸收CO2的。
本题难度:一般
3、选择题 25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃4L与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了9L,原混合烃中乙烷、乙炔和丙烯的体积比不可能为
A.1:1:1
B.2:1:1
C.3:2:3
D.5:3:4
参考答案:A
本题解析:乙烷、乙炔和丙烯燃烧的化学方程式分别是2C2H6+7O2=4CO2+6H2O;2C2H2+5O2=4CO2+2H2O;2C3H6+9O2=6CO2+6H2O.由方程式可以看出C2H6、C3H6若有2体积的完全反应,则反应前后气体的体积都减少5体积,C2H2若有2体积的完全反应,则反应前后气体的体积减3体积。现在混合烃4L反应前后气体的体积都减少9体积.即混合烃2L反应前后气体的体积都减少4.5体积.则根据十字交叉法可得C2H6和C3H6的混合气体与C2H2的体积比为3:1,C2H6和C3H6为任意比。即在a:b:c中只要满足a+c=3b即可。分析各个选项,可知不符合条件的为A。
本题难度:一般
4、实验题 已知某醇燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
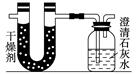
?
| 实验前
| 实验后
|
(干燥剂+U形管)的质量
| 101.1 g
| 102.9 g
|
(石灰水+广口瓶)的质量
| 312.0 g
| 314.2 g
|
?
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________ g,
假设广口瓶里生成一种正盐,其质量为________ g;
(2)生成的水中氢元素的质量为________ g;
(3)生成的二氧化碳中碳元素的质量为________ g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为__________,结构简式为_______________________________。
参考答案:(1)1.8 5 (2)0.2 (3)0.6 (4)3∶1
(5)CH4O CH3OH
本题解析:(1)m(H2O)=102.9 g-101.1 g=1.8 g
m(CO2)=314.2 g-312.0 g=2.2 g
则n(CaCO3)=n(CO2)=0.05 mol
m(CaCO3)=5 g
(2)m (H)=m(H2O)×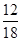 =1.8 g×
=1.8 g×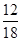 =0.2 g
=0.2 g
(3)m(C)=m(CO2)×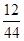 =2.2 g×
=2.2 g×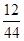 =0.6 g
=0.6 g
(4)m(C)∶m(H)=0.6 g∶0.2 g=3∶1
(5)该燃料分子中C、H的原子个数比为:
N(C)∶N(H)=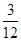 ∶
∶ =1∶4。
=1∶4。
据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1∶4时,分子中只能含CH4,而不能为CH4的整数倍,又因为每个分子中含有一个氧原子,则该醇的分子式为CH4O,结构简式为CH3OH。
本题难度:一般
5、选择题 将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(严禁振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是
?
| 甲
| 乙
| 丙
|
A
| 1,2—二溴乙烷
| 水
| 苯
|
B
| 溴苯
| 液溴
| 乙醇
|
C
| 水
| 大豆油
| 溴水
|
D
| 乙醇
| 乙酸
| 乙酸乙酯
参考答案:A
本题解析:由图可知,甲、乙、丙的密度中,丙的密度最小,甲的密度最大;甲与乙不相溶,乙与丙不相溶。A、苯的密度最小,1,2—二溴乙烷的密度最大,苯与水不相溶,水与1,2—二溴乙烷不相溶,正确;B、三种物质互溶,错误;C、三种物质中,乙的密度最小,所以最上层是乙,错误;D、三种物质互溶,错误,答案选A。
本题难度:一般
|