1、计算题 用足量的NaOH吸收448mLCl2(标准状况)氯气,计算生成NaCl的物质的量。
参考答案:
本题解析:在标况下,448 mLCl2即氯气物质的量为0.448除以22.4等于0.02mol。再由2NaOH+Cl2=NaCl+NaClO+H2O 因此可以生成氯化钠物质的量为0.02mol.故氯化钠的质量为1.17克。
考点:
本题难度:一般
2、选择题 若设NA=1mol×6.02×1023mol-1,下列叙述中正确的是( )
A.将162.5gFeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数等于NA
B.标准状况下,22.4LCCl4中碳原子的个数约为NA
C.含有NA个氖原子的氖气在标准状况下的体积约为11.2L
D.标准状况下,用NaOH溶液吸收氯气22.4L,反应中转移的电子数目为NA
参考答案:A.胶体粒子是由多个“分子”组成的集合体,将162.5gFeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数小于NA,故A错误;
B.标准状况下CCl4为液体,无法计算22.4LCCl4的物质的量,故B错误;
C.氖气为单原子分子,含有NA个氖原子的氖气在标准状况下的体积约为22.4L,故C错误;
D.n(Cl2)=1mol,与NaOH反应的电子转移的方向和数目为
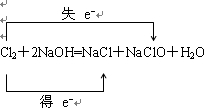
,反应中转移的电子数目为NA,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是?
[? ]
A.48 g O3气体含有6.02×1023个O3分子
B.常温常压下,4.6 gNO2气体含有1.81×1023个NO2分子
C.0.5 mol/L 1 L CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
参考答案:B
本题解析:
本题难度:简单
4、选择题 NA表示阿伏加德罗常数。下列说法中正确的是
[? ]
A. 200 mL1 mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
B. O2和O3的混合物共4.8 g,其中所含氧分子数为0.3NA
C. 一定条件下,0.1 mol Fe与0.2mol Cl2充分反应,转移的电子数为0.3NA
D. 标准状况下,22.4 LNO和11.2 LO2混合后气体的分子总数为1.5NA
参考答案:C
本题解析:
本题难度:简单
5、选择题 NA表示阿伏加德罗常数值.下列说法正确的是
A.1mol?Na2O2与足量CO2充分反应转移的电子数为2NA
B.标准状况下,2.24?L?CHCl3的分子数为0.1?NA
C.t℃时,1L?pH=6的纯水中,含1×10-6?NA个OH-
D.向FeI2溶液中通入适量氯气,当有1mol?Fe2+被氧化时,共转移电子的数目为1?NA
参考答案:C
本题解析:分析:A.过氧化钠既是氧化剂又是还原剂,过氧根离子中的氧为-1价,一半氧原子化合价升高,生成氧气,另一半氧原子化合价降低,生成-2价的氧;
B.CHCl3是液体;
C.在纯水中氢离子浓度等于氢氧根浓度;
D.碘离子也能被氯气氧化.
解答:A.过氧化钠既是氧化剂又是还原剂,过氧根离子中的氧为-1价,一半氧原子化合价升高,生成氧气,另一半氧原子化合价降低,生成-2价的氧,故1 mol过氧化钠参与反应时转移电子的量为1 mol,转移的电子数为1NA,故A错误;
B.标准状况下,2.24?L?CHCl3的物质的量不是0.1mol,故B错误;
C.在纯水中氢离子浓度等于氢氧根浓度=1×10-6?mol/l,故C正确;
D.二价铁离子和碘离子都能被氯气氧化,先氧化碘离子,当有1molFe2+被氧化时,共转移电子的数目大于1?NA,故D错误.
故选C.
点评:本题考查阿伏加德罗常数,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.
本题难度:一般