1、选择题 可用于判断碳酸氢钠溶液中混有碳酸钠的实验方法是( )
A.加热时有无气体放出
B.溶于水后滴加氯化钡稀溶液,有白色沉淀生成
C.滴加盐酸时有无气泡放出
D.溶于水后滴加澄清石灰水,有白色沉淀生成
参考答案:B
本题解析:
本题难度:简单
2、推断题 A.B.C.D四种化合物,其中A.C.D焰色反应均为黄色,而B的焰色反应为紫色,A.C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可得到C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。
试推断: A:――B:――C:――E:――
参考答案:A:NaCO3B:KOHC:NaHCO3E:Fe(OH)3
本题解析:
本题难度:一般
3、填空题 Na2CO3与NaHCO3在一定条件下可以相互转化
(1)请用化学方程式表示除去Na2CO3固体中NaHCO3固体:______
(2)请用离子方程式表示除去NaHCO3溶液中含有的Na2CO3溶质:______
(3)充分加热Na2CO3与NaHCO3的固体混合物95g到恒重,固体质量减少31g,求混合物中Na2CO3的质量分数:______(结果保留一位小数).
参考答案:(1)NaHCO3不稳定,加热易分解,可用加热的方法除杂,反应的方程式为2NaHCO3?△?.?Na2CO3+H2O+CO2↑,故答案为:2NaHCO3?△?.?Na2CO3+H2O+CO2↑;
(2)除去NaHCO3溶液中含有的Na2CO3溶质可在溶液中通入过量二氧化碳气体,Na2CO3溶液可与二氧化碳反应生成NaHCO3,反应的离子方程式为CO32-+H2O+CO2=2HCO3-,
故答案为:CO32-+H2O+CO2=2HCO3-;
(3)设混合物中含有NaHCO3xg,
2NaHCO3?△?.?Na2CO3+H2O+CO2↑△m
168g? 62g
xg? 31g
x=84,
则Na2CO3的质量为95g-84g=11g,
ω(Na2CO3)=1195×100%=11.6%,
故答案为:11.6%.
本题解析:
本题难度:一般
4、填空题 以Na2CO3、NaHCO3和CaCO3为原料与酸反应都可产生CO2,试从反应的快慢、反应装置和酸的选择等方面,比较制取CO2适用的是________________。
参考答案:应选用CaCO3和稀盐酸反应比较好
本题解析:
本题难度:一般
5、实验题 工业纯碱中常含有NaCl、Na2SO4等杂质,可用如图所示的装置测定工业纯碱中有效成分的含量。
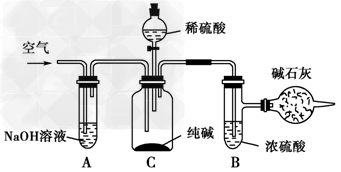
实验过程的主要步骤是:
①准确称取干燥试样x?g(x>2),放入广口瓶C中。
②准确称量装有碱石灰的干燥管的质量为y?g。
③从分液漏斗中缓缓注入稀硫酸,至不再产生气体为止。
④缓缓鼓入空气数分钟,然后将干燥管取下,准确称其质量为W?g。
根据以上实验,填写下列空格:
(1)装置A的作用是__________________,如果不用装置A,会导致实验结果偏________(填“大”、“小”或“不变”,下同)。
(2)装置B的作用是__________________,如果不用装置B,会导致实验结果偏________。
(3)通入空气的作用是 _______________________。如果不通入空气,会导致实验结果偏________。
参考答案:(1)除去空气中的CO2;大
(2)吸收水分,干燥CO2;大
(3)使广口瓶中由Na2CO3与H2SO4反应产生的CO2排出;小
本题解析:
本题难度:一般