1、简答题 表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)上述所列元素中,最高价氧化物的水化物中酸性最强的是______(填化学式).
(2)d、e、f三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)______.
(3)a、c两种元素可形成多种化合物,其中化合物A的产量是衡量一个国家石油化工发展水平的标志,则:
①A的结构简式为______;以A为原料,可制得当今世界上产量最大的塑料产品,该反应的化学方程式为______;
②A可与H2O反应生成化合物B,该反应类型为______.B与CH3COOH反应生成有果香气味的产物,该反应的化学方程式为______.
(4)从b、f形成的化合物与d、f形成的化合物的混合物中分离提纯d、f形成的化合物,可加入上述______(用元素符号表示)两种元素形成的化合物的水溶液后再过滤洗涤.
(5)元素e的气态氢化物与其最高价氧化物 的水化物反应生成的物质为______(用化学式表示),该物质所含化学键类型为______,属于______化合物(填“离子”或“共价”).
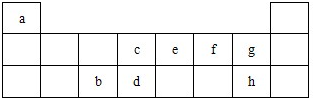
参考答案:根据元素所在周期表中的位置可知a为H元素,b为Al元素,c为C元素,d为Si元素,e为N元素,f为O元素,g为F元素,h为Cl元素,
(1)HClO4是酸性最强的无机含氧酸,故答案为:HClO4;
(2)非金属性越强氢化物越稳定,由元素在周期表的位置可知,非金属性Si<N<O,故氢化物稳定性SiH4<NH3<H2O,故答案为:SiH4<NH3<H2O;
(3)H、C两种元素可形成多种化合物,化合物A的产量是衡量一个国家石油化工发展水平的标志,则A为乙烯,
①A的结构简式为C2H4,乙烯发生加聚反应得到聚乙烯,方程式为: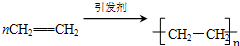 ,
,
故答案为:C2H4; ;
;
②乙烯与水发生加成反应生成的B,B为CH3CH2OH,以乙酸反应生成乙酸乙酯,方程式为:CH3COOH+CH3CH2OH浓硫酸
本题解析:
本题难度:一般
2、选择题 下列递变情况中不正确的是( )
A.钠、镁、铝原子的最外层电子数依次增多
B.硅、磷、硫、氯元素的最高正化合价依次升高
C.碳、氮、氧、氟的原子半径依次增大
D.锂、钠、钾、铷的金属性依次增强
参考答案:A.钠、镁、铝位于周期表相同周期,从左到右原子的最外层电子数依次增多,故A正确;
B.硅、磷、硫、氯元素的最高正化合价依次为+4、+5、+6、+7,以此升高,故B正确;
C.同周期元素从左到右原子半径逐渐减小,则碳、氮、氧、氟的原子半径依次减小,故C错误;
D.同主族元素从上到下元素的金属性逐渐增强,则锂、钠、钾、铷的金属性依次增强,故D正确.
故选C.
本题解析:
本题难度:简单
3、简答题 如图是元素周期表的一部分,针对表中的①~⑧八种元素,用元素符号或化学式回答相关问题:
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
二
①
三
②
③
④
⑤
⑥
四
⑦
⑧
|
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为______.
(2)地壳中含量最多的金属元素是______.
(3)用电子式表示①与③形成化合物的过程:______.
(4)这些元素的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是______,显两性的是______,该两性物质与②的最高价氧化物对应水化物的溶液反应的离子方程式为______.
(5)①②③④四种元素的简单离子核外电子排布相同,都有______个电子,它们的离子半径由大到小顺序是______(用“>”表示).
(6)①⑤⑧三种元素的单质沸点由高到低的顺序是______(用“>”表示).
参考答案:根据元素周期表中短周期元素的分布情况,可以知道①是F,②是Na,③是Mg,④是Al,⑤是Cl,⑥是Ar,⑦是K,⑧是Br.
(1)在这些元素中,化学性质最不活泼的元素的原子是稀有气体元素的原子,即为Ar,原子结构示意图为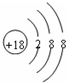 ,故答案为:
,故答案为: ;
;
(2)地壳中含量最多的金属元素是铝,故答案为:Al;
(3)氟化镁是氟离子和镁离子间通过离子键形成的离子化合物,其形成过程为: ,
,
故答案为: ;
;
(4)周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以酸性最强的是HClO4;碱性最强的是KOH;具有两性的是Al(OH)3,既能和强碱反应有能和强酸反应,实质是:Al(OH)3+OH-=AlO2-+2H2O,故答案为:HClO4;KOH;Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(5)F-、Na+、Mg2+、Al3+的简单离子核外电子数均为10,核外电子数一样的离子则核电荷数越多半径越小,即F->Na+>Mg2+>Al3+,故答案为:F->Na+>Mg2+>Al3+;.
(6)氟气、氯气、液溴单质的分子量逐渐增大,沸点由高到低的顺序是Br2>Cl2>F2,故答案为:Br2>Cl2>F2.
本题解析:
本题难度:一般
4、选择题 下列有关化学用语正确的是( )
A.NH3分子比例模型:

B.质量数为3的重氢原子:D
C.-OH的电子式:

D.乙烯的结构简式:CH2CH2
参考答案:A.图示的模型是NH3分子的球棍模型,故A错误;
B.质量数为3的重氢原子:T,故B错误;
C.羟基不带电,共有7个电子,加上氧的内层有2个电子,共9个电子,而氧与氢的质子数之和也为9,所以其不带电,故C正确;
D.乙烯的结构简式为CH2=CH2,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 下列叙述正确的是( )
A.IA族金属元素是同周期中金属性最强的元素
B.不同元素的原子构成的分子中一定只含极性共价键
C.
U和U是中子数不同质子数相同的同种核素
D.ⅦA族元素的简单阴离子还原性越强,其最高价氧化物对应水化物的酸性就越强
参考答案:A、在周期表中,从左到右金属性逐渐减弱,所以IA族金属元素是同周期中金属性最强的元素,故A正确;
B、不同元素的原子构成的分子中可能含有非极性键,如H2O2既含有极性共价键又含有非极性共价键,故B错误;
C、中子数不同质子数相同的不是同种核素,则23592U和23892U是中子数不同质子数相同的同种元素的不同核素,互称同位素,故C错误;
D、ⅦA族元素的简单阴离子还原性越强,则对应的非金属性越弱,其最高价氧化物对应水化物的酸性就越弱,故D错误;
故选A.
本题解析:
本题难度:一般