1、选择题 已知次碘酸(HIO)既能和酸又能和碱发生中和反应.它与盐酸发生反应将生成
A.ICl
B.IOCl
C.HClO
D.HI
参考答案:A
本题解析:分析:次碘酸(HIO)既能和酸又能和碱发生中和反应,说明次碘酸既能发生酸式电离也能碱式电离,据此分析解答.
解答:HIO既能和酸又能和碱发生中和反应,即:HIO发生如下电离:H++IO-?HIO?I++OH-,当次碘酸和盐酸反应时,次碘酸呈碱式电离生成碘离子和氢氧根离子,所以次碘酸和盐酸反应生成氯化碘和水,故选A.
点评:本题考查了电解质在水溶液中的电离,难度较大,能明确次碘酸的酸碱式电离是解本题的关键.
本题难度:一般
2、选择题 下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据,下列说法正确的是
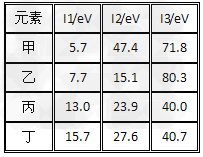
[? ]
A?甲的金属性比乙强?
B?乙的化合价为+1价
C?丙一定为非金属元素?
D?丁一定是金属元素
参考答案:AC
本题解析:
本题难度:简单
3、填空题 第一电离能I1;________态电_______性基态原子失去________个电子,转化为气态基态正离子所需要的
________叫做第一电离能。第一电离能越大,金属活动性越________。同一元素的第二电离能________第一电离能。
参考答案:气;中;1;能量;小;> (或大于)
本题解析:
本题难度:一般
4、选择题 下列对一些实验事实的理论解释正确的是( )
A.实验事实:氮原子的第一电离能大于氧原子;理论解释:氮原子2p能级半充满
B.实验事实:CO2为直线性分子;理论解释:CO2分子中C=O之间的夹角为180°
C.实验事实:金刚石的熔点低于石墨;理论解释:金刚石是分子晶体,石墨是原子晶体
D.实验事实:HF的沸点高于HCl;理论解释:HF的相对分子质量小于HCl
参考答案:A
本题解析:
本题难度:一般
5、简答题 W、X、Y、Z四种元素原子序数依次减小.已知W的原子序数为29;X原子p轨道共有11个电子;Y是第三周期主族元素,其部分电离能数据如下表;Z原子价电子排布式为nsnnpn.请回答下列问题:
| 电离能/(kJ?mol-1) | I1 | I2 | I3 | I4 | I5
Y
584
1823
2751
11584
14837
|
(1)W基态原子的电子排布式为______.
(2)电负性:X______Y(填“>”、“=”或“<”).
(3)R是与X同主族的短周期元素.R的氢化物沸点比X的氢化物高,原因是______.
(4)Z2X4中,Z原子采用______杂化,每个分子中含有______个σ键,______个π键.
(5)已知W2+能与氨分子形成配离子[W(NH3)4]2+,该配离子中存在的化学键有______.(填标号)
A.金属键B.离子键C.共价键D.配位键.
参考答案:W、X、Y、Z4种元素原子序数依次减小,W的原子序数为24,所以W是铬元素;X原子p轨道共有11个电子,第二周期的P轨道含6的电子,第三周期的P轨道含有5的电子,所以X是Cl元素;Y是第三周期主族元素,第一、二、三电离能较小,第四电离能较大,所以其化合价为+3价,故为Al元素;Z原子价电子排布式为nsnnpn,s能级上最多排2个电子,所以其价电子排布为2s22p2,故为C元素,
(1)原子序数为24的元素是铬,其核外电子排布式为:1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(2)通过以上分析知,X是氯元素,Y是铝元素,它们属于同一周期的元素,且氯元素的原子序数大于铝元素的原子序数,同一周期中,元素的电负性随着原子序数的增大而增大,所以电负性X>Y,
故答案为:>;
(3)R是与X同主族的短周期元素,X是氯元素,所以R是氟元素,R的氢化物沸点比X的氢化物更高,氟化氢中存在氢键,氯化氢中没有氢键只有范德华力,氢键的存在导致其沸点升高,
故答案为:氟化氢分子间形成了氢键,而氯化氢分子间只有范德华力;
(4)Z为C,X为Cl元素,则Z2X4为C2Cl4,分子中存在1个碳碳双键和5个C-Clσ键,1个碳碳双键含有一个π键和一个σ键,每个C原子形成了3个σ键,所以C原子采取sp2杂化,分子中含有5个σ键、1个π键,
故答案为:sp2;5;1;
(5)W为铬元素,配离子[W(NH3)6]3+中存在的键有:铬离子和氮原子之间存在配位键,氮原子和氢原子间存在共价键,
故选CD.
本题解析:
本题难度:一般