1、选择题 能正确表示下列化学反应的离子方程式的是( )
A.氢氧化铜与盐酸的反应:OH-+H+===H2O
B.澄清石灰水与稀盐酸的反应:Ca(OH)2+2H+===Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D.碳酸钙溶于稀盐酸中:CaCO3+2H+===Ca2++H2O+CO2↑
参考答案:D
本题解析:氢氧化铜是难溶性物质,应该用化学式表示,A不正确;澄清的石灰水应该用离子表示,B不正确;选项C中电子的得失不守恒,因此正确的答案选D。
点评:归判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。
本题难度:一般
2、选择题 下列反应的离子方程式正确的是
[? ]
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑
+8H2O
B.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
C.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D.向溴化亚铁溶液中通入等物质的量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
参考答案:D
本题解析:
本题难度:一般
3、选择题 能正确表示下列化学反应的离子方程式是
A.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
B.碳酸镁溶于硝酸中:2H++CO32-=CO2↑+H2O
C.在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO3-=CO2↑+H2O
参考答案:D
本题解析:A项:电荷不守恒,故错;B项:碳酸镁为难溶物,不能拆开,故错;C项:违反客观事实,故错。故选D。
点评:离子方程式正误判断要注意:看原则:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等。可溶的易电离的物质拆成离子。注意过量、少量、适量等。
本题难度:一般
4、选择题 能正确表示下列反应的离子方程式的是
A.以石墨为电极电解MgCl2溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.NH4Cl水溶液显酸性:NH4++H2O=NH3 H2O+H+
H2O+H+
C.AlCl3溶液中投入过量Na:Al3++4Na+2H2O=AlO2-+4Na++2 H2↑
D.FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
参考答案:
C
本题解析:
A项,电解方程式为 +2Cl-
+2Cl-
 +Cl2↑;B项,水解反应应为可逆反应;D项,少量的Cl2只能把Fe2+氧化到Fe3+,而不能把Br-氧化(过量则可以)。
+Cl2↑;B项,水解反应应为可逆反应;D项,少量的Cl2只能把Fe2+氧化到Fe3+,而不能把Br-氧化(过量则可以)。
本题难度:一般
5、选择题 下列离子方程式与所述事实相符且正确的是
A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2+ +2HCO3-+2OH-=CaCO3↓+CO32-+H2O
B.磁性氧化铁溶于稀硝酸:3Fe2++4H ++NO3-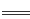 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
C.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4 Fe2++2 Br-+3Cl2=4Fe3++6Cl-+Br2
D.以铜为电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
参考答案:C
本题解析:A、Ca(HCO3)2溶液中加入少量NaOH溶液,Ca(HCO3)2过量,HCO3?的系数为1,错误;B、磁性氧化铁为Fe3O4,在离子方程式中应用化学式表示,错误;C、由电子守恒可知,亚铁离子全部被氧化,0.2mol溴离子被氧化,所以离子方程式为:4 Fe2++2 Br-+3Cl2=4Fe3++6Cl-+Br2,正确;D、以铜为电极电解饱和食盐水,阳极上Cu失电子,离子方程式为:Cu+2H2O  Cu(OH)2↓+H2↑,错误。
Cu(OH)2↓+H2↑,错误。
本题难度:一般