1、填空题 (12分)下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。
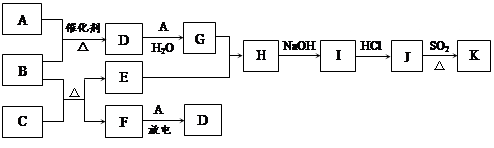
请回答下列问题:
(1)B的电子式为?。
(2)J、K是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式?。
(3)汽车尾气中常含有D。B与D在加热和催化剂存在的条件下,发生反应生成两种对空气无污染的物质。请写出该反应的化学方程式?。
(4)有人认为:“表面化学”研究成果能使B和D的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高。请你应用化学基本理论对此观点进行评价:?。
参考答案:(1)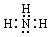 ?(2)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
?(2)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
(3)6NO+4NH3 ?5N2+6H2O?
?5N2+6H2O?
(4)该研究只能提高化学反应速率,不能使化学平衡发生移动?(每空3分,共12分)
本题解析:本题是无机框图题,关键是找准突破点。E为红色金属单质,所以E是Cu;B为具有刺激性气味的气体,C为黑色氧化物,则B是氨气,C是氧化铜,F是氮气;G能溶解单质铜,所以A是氧气,D是NO,G是硝酸,H是硝酸铜,I是氢氧化铜,J是氯化铜。SO2具有还原性,能含有氯化铜,所以生成K的反应是氧化还原反应,则K是氯化亚铜。
(1)氨气是含有极性键的化合物,电子式是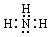 。
。
(2)SO2含有氯化铜生成氯化亚铜,而SO2被氧化生成硫酸,方程式是2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-。
(3)NO具有氧化性,能氧化氨气生成氮气和水,方程式是6NO+4NH3 ?5N2+6H2O。
?5N2+6H2O。
(4)催化剂只能改变反应速率,但不能影响化学平衡状态,即该研究只能提高化学反应速率,不能使化学平衡发生移动。
本题难度:一般
2、填空题 有A、B两种常温下有刺激性气味的气体,将黄绿色气体A通入品红溶液中,品红溶液变为无色;将气体B通入品红溶液中,品红溶液也变为无色;将气体A和气体B按1:1的体积比混合充分,通入品红溶液中,品红溶液不褪色,通入紫色石蕊试液中,溶液只变红不褪色.试回答下列问题:
(1)写出A、B的化学式:______、______
(2)写出A和NaOH溶液反应的化学方程式:______
(3)写出B与NaOH溶液反应的离子方程式:______
(4)写出A与B按1:1的体积比混合通入水中充分反应的化学方程式:______
(5)加热通入A后变为无色的品红溶液,现象是______;加热通入B后变为无色的品红溶液,现象是______.
参考答案:(1)具有漂白作用,能使品红溶液褪色的气体有Cl2、SO2、O3等,黄绿色气体A通入品红溶液中,品红溶液变为无色,所以A为Cl2,将气体B通入品红溶液中,品红溶液也变为无色,则B为SO2,故答案为:Cl2;SO2;
(2)氯气在NaOH溶液中自身发生氧化还原反应生成NaCl和NaClO,反应的方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)二氧化硫为酸性气体,与NaOH反应生成Na2SO3,反应的离子方程式为SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
(4)Cl2与SO2发生氧化还原反应生成H2SO4和HCl,反应的化学方程式为Cl2+SO2+H2O=H2SO4+2HCl,
故答案为:Cl2+SO2+H2O=H2SO4+2HCl;
(5)二氧化硫具有漂白性,漂白原理是与有色物质发生化合反应生成不稳定的有色物质,不稳定,加热后能够复原,而氯气的漂白原理是由于氯气和水反应生成具有强氧化性的次氯酸,不能复原,
故答案为:无现象;溶液变红.
本题解析:
本题难度:一般
3、选择题 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如 右图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
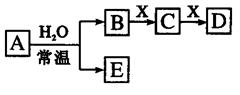
A.若X是Na2CO3,C为CO2,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3- =H2O+ CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
参考答案:A
本题解析:试题分析:若X是Na2CO3,C为CO2,则B为HCl,D为NaHCO3,A为Cl2,E为HClO,D与E可以发生反应,生成NaClO.因此,选项A说法错误。故答案选A。
考点:物质的性质
点评:本题以选择题的形式考查了物质的性质,属于综合性较强的题目。解题的关键在于熟练掌握相关物质的性质,属于中档题。
本题难度:简单
4、简答题 下图①-11分别代表有关反应中的一种物质,请填下以下空白.
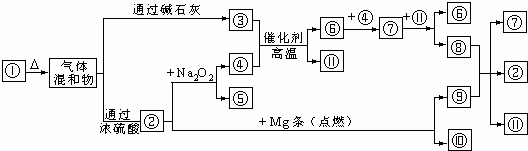
(1)①、③、④的化学式分别是______、______、______.
(2)⑧与⑨反应的化学方程式是______.
参考答案:碱石灰吸收水和酸性氧化物,浓硫酸吸收碱性气体和水,①加热后的混合物通过碱石灰后还有气体,则③是碱性气体,为氨气,混合物通过浓硫酸后还剩酸性气体,酸性气体和过氧化钠反应、和镁反应,二氧化碳和过氧化钠、镁都能反应,所以②是二氧化碳;二氧化碳和过氧化钠反应生成碳酸钠和氧气,氨气和氧气反应,所以④是氧气⑤是碳酸钠;氨气和氧气反应生成一氧化氮和水,⑥和氧气反应,所以⑥一氧化氮,11是水;⑦是二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,⑧是硝酸;二氧化碳和镁反应生成氧化镁和碳,硝酸和⑨反应生成二氧化碳、二氧化氮、和水,根据元素守恒知,⑨是碳,⑩是镁,加热溶解生成氨气、水和二氧化碳的物质是碳酸氢铵,则①是碳酸氢铵.
(1)通过以上分析知,①是NH4HCO3,③是NH3,④是O2,故答案为:NH4HCO3;NH3;O2;
(2)加热条件下,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,反应方程式为C+4HNO3(浓)?△?.?2H2O+4NO2↑+CO2↑,
故答案为:C+4HNO3(浓)?△?.?2H2O+4NO2↑+CO2↑.
本题解析:
本题难度:一般
5、推断题 有一学生取两份A溶液做实验,实验步骤和实验现象如下所示(C不考虑是微溶物)
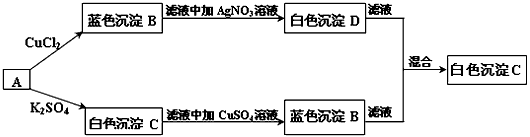
(1)写出化学式:A___________,B___________,C___________,D___________;
(2)写出下列反应的离子方程式
A → B______________________;
A → C______________________。
参考答案:(1)A:Ba(OH)2;B:Cu(OH)2;C:BaSO4;D:AgCl
(2)Cu2++2OH-==Cu(OH)2↓;Ba2++SO42-==BaSO4↓
本题解析:
本题难度:一般