1、选择题 下列气态氢化物中最稳定的是( )
A.CH4
B.SiH4
C.H2S
D.HCl
参考答案:对于C、Si、S、Cl四种非金属元素来说,Si、S、Cl处于同一周期,同周期从左到右元素的非金属性增强,即非金属性Si<S<Cl;
C和Si处于同一主族,同主族从上到下非金属性减弱,即非金属性C>Si.对C和Cl来说,可以形成CCl4,说明Cl得电子能力比C强,即非金属性Cl>C.
综合上述分析,C、Si、S、Cl四种非金属元素中Cl的非金属性最强,即其氢化物HCl在CH4、SiH4、H2S、HCl中最稳定.
故选D.
本题解析:
本题难度:简单
2、选择题 下列粒子半径之比大于1的是
A.K+/K
B.Mg / Ca
C.O2- / Na+
D.Cl / Cl-
参考答案:C
本题解析:阳离子比较小于原子半径,阴离子比较大于原子半径,A和D都小于1。同主族自上而下原子半径之间减小,所以B是小于1的。核外电子排布相同的微粒,其微粒比较随原子序数的增大而减小,所以C正确。答案选C。
本题难度:困难
3、选择题 卤素按F、Cl、Br、I顺序其非金属性逐渐减弱的原因是
A.原子核内质子数增多起主要作用
B.相对原子质量逐渐增大起主要作用
C.其单质的密度增大起主要作用
D.随着电子层数增加,原子半径增大起主要作用
参考答案:D
本题解析:
本题难度:一般
4、推断题 具有相同电子层结构的A、B两种离子,可组成AB型离子化合物。A、B的单质在常温时都可与水剧烈反应。试推断: ?
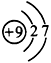
(1)A离子的结构示意图________;B原子的结构示意图___________。 ?
(2)A单质与水反应的离子方程式为__________________。 ?
(3)B单质与水反应的化学方程式为__________________。
参考答案:(1)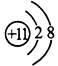 ;
;
(2)2Na+2H2O=2Na++2OH-+H2↑?
(3)2F2+2H2O=4HF+O2
本题解析:
本题难度:一般
5、选择题 下列说法不正确的是
[? ]
A.IA族元素的电负性从上到下逐渐减小,而ⅦA族元素的电负性从上到下逐渐增大
B.电负性的大小可以作为衡量元素的金属性和非金属性强弱的量度
C.氢原子中只有一个电子,故氢原子只有一个原子轨道
D.NaH的存在能支持可将氢元素放在ⅦA的观点
参考答案:AC
本题解析:
本题难度:简单