1、计算题 锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有??(任写一种方法)。碳酸锶与盐酸反应的离子方程式为?。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为?。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水? B.氢氧化钠? C. 氢氧化锶粉末? D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和??(填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是??。
A.50~60℃? B.70~80℃? C.80~100℃?D.100℃以上?
(5)若滤液中Ba2+?浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于?mol/L。
?
| SrSO4
| BaSO4
| Sr(OH)2
|
Ksp
| 3.3×10—7
| 1.1×10—10
| 3.2×10—4
|
?
2、选择题 下列物质的转化,不能通过一步反应完成的是( )
A.Na2CO3→Na2SiO3
B.SiO2→H2SiO3
C.KBr→KCl
D.SiO2→Si
3、选择题 根据海水综合利用的工业流程图(如图),判断下列说法正确的是(? )
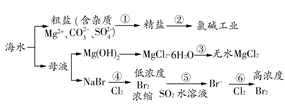
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2 mol Br-,需消耗2.24 L Cl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
4、选择题 “白色污染”是环保治理的一个重要方面,“白色污染”是指工业或生活中排放或废弃的(?)
A.工业废气
B.工业废水
C.矿渣
D.塑料
5、填空题 (12分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O及纳米材料G,主要步骤如下:

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2 +生成沉淀的pH 分别如下:
物质
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe(OH)3
| 2.2
| 3.2
|
Fe(OH)2
| 7.6
| 9.6
|
Cu(OH)2
| 4.7
| 6.4
|
请回答下列问题:
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]______(填“>”或“<”)Ksp[Cu(OH)2]。
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,目的是氧化_____________(填离子符号)。该工厂选用试剂①最好为下列中的?(填代号)。
a.? Na2O2 ?b. H2O2? c. Cl2? d. KSCN
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在_______℃,pH控制在________,氧化时间为________小时左右。

(4)向溶液B中加入试剂②的化学式为_______,操作Ⅰ的名称是_________。
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为_____________________________________________。取A溶液20.00 mL,用去0.0240 mol/L KMnO4溶液16.00 mL时恰好达到滴定终点,则A溶液中Fe2+浓度为?。