1、选择题 拟用下图所示装置制取四种干燥、纯净的气体(图 中加热装置和气体的收集装置均已略去:必要时可以加热;a、b、c、d表示相应仪 器中加入的试剂)。其中不不能达到目的的是?
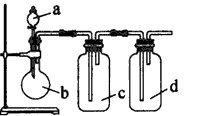
[? ]
? 制取气体
a
b
c
d
A
NO
稀硝酸
铜片
H2O
浓硫酸
B
O2?
双氧水
MnO2
H2O
浓硫酸
C
NH3
浓氨水
碱石灰
浓硫酸
H2O
D
SO2?
浓盐酸
Na2SO3粉末
NaHSO3溶液
浓硫酸
参考答案:C
本题解析:
本题难度:一般
2、填空题 (10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
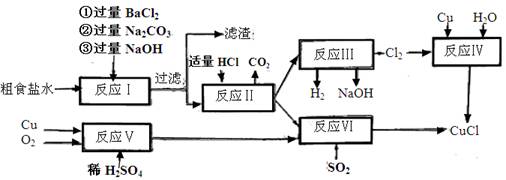
(1)反应I中加Na2CO3溶液的作用是?。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为?。
(3)①写出反应V的化学方程式?
②写出反应VI的离子反应方程式?。
(4)在整个合成过程中可以循环利用的物质是?
(5)反应IV加入的Cu必须过量,其目的是?。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是? ?。
?。
参考答案:(10分,每空2分)
(1)除去Ca2+和过量的Ba2+(2分)
(2)2Cl—2e-=Cl2↑(2分)
(3)①2Cu+O2+2H2SO4=2CuSO4+2H2O(3分)
②2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4(3分)
或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4
(4)H2SO4? NaOH (可以写名称各1分))(共2分)
(5)在防止生成CuCl2(2分)
(6)加快乙醇和水的蒸发,(1分)防止CuCl被空气氧化(1分) (共2分)
本题解析:反应I是粗盐不的除杂过程,过滤后的滤液中加入适量盐酸(反应II),得到纯净的NaCl溶液;反应III是电解食盐水得到氯气,与铜、水一起制取CuCl。
反应V是制取硫酸铜,与SO2、NaCl通过反应VI也可制取CuCl
(1)在除杂过程中加Na2CO3溶液有两个作用:除去原溶液中的Ca2+及引入的Ba2+;
(2)电解食盐水:阳极:2Cl—2e-=Cl2↑;阴极:2H+ +2e-=H2↑;总反应式:2NaCl+2H2O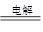 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)反应V中铜氧化为氧化铜,再与硫酸反应可得硫酸铜;
(4)由工艺流程可知,反应V消耗硫酸,而反应VI可产生硫酸;反应I消耗NaOH,而反应III电解食盐水过程中又可生产NaOH溶液。故在整个合成过程中可以循环利用的物质是硫酸和烧碱
(5)由于氯气氧化性强,与铜反应时时容易生成氯化铜
(6)结合题目所给信息,在真空机中可防止产品的氧化、70℃温度可加快乙醇和水的蒸发
本题难度:一般
3、填空题 (10分)某同学用18 mol/L的浓硫酸配制200mL 0.9mol/L的稀硫酸,并进行有关实验。请回答下列问题:
(1)需要量取浓硫酸? ?mL(准确到小数点后一位)。
(2)配制该稀硫酸时使用的仪器除量筒、烧杯、200mL容量瓶外,还必须用到的仪器有? ?、? ?等。
(3)容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中移入液体时,需要一定的耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是(? )
A.可以按此建议改进,便于使用容量瓶
B.不能按此建议改进,因为会降低容量瓶的精确度
C.如果加粗瓶颈,可将原来刻在容量瓶瓶颈上的刻度线改刻在容量瓶的瓶身上
D.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响
(4)在配制过程中,下列因素对所配制的稀硫酸的物质的量浓度有何影响?
若容量瓶未干燥即用来配制溶液,则所得溶液浓度? 0.9 mol·L-1(填“大于”、“等于”或“小于”,下同);若定容时俯视刻度线,则所得溶液浓度? 0.9 mol·L-1。
参考答案:(共10分) (1)10.0? (2分)
(2)玻璃棒?胶头滴管(可颠倒)。(每空1分)
(3)B(2分)?(4)等于?大于(每空2分)
本题解析:(1)在浓硫酸的稀释过程中,溶质是不变的,所以需要量取浓硫酸的体积是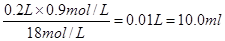 。
。
(2)稀释浓硫酸、向容量瓶中转移硫酸时都需要玻璃棒。另外定容时还需要胶头滴管。
(3)根据容量瓶的结构可知,瓶颈越粗,精确度越低,所以该建议不可取,答案选B。
(4)根据n=c·V可知,如果容量瓶没有干燥,则溶质的溶液的体积不受影响,浓度不变;如果定容时俯视刻度线,则所得溶液的体积偏少,浓度偏高。
点评:该题是高考中的常见题型,属于中等难度的试题。试题侧重考查学生的基础知识,兼顾能力的考查。该题的难度在于误差分析,配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。由于引起误差的原因复杂,所以误差分析就成为高考化学实验中的一个难点。
本题难度:一般
4、选择题 配制100mL0.5mol/LNaOH溶液的操作有?①计算 ②冷却 ③洗涤 ④溶解 ⑤转移 ⑥称量?⑦定容,次序正确的是
A.①⑥③②⑤④⑦
B.①⑥④⑤②③⑦
C.①⑥④②⑤③⑦
D.①⑥③④⑤②⑦
参考答案:C
本题解析:配置溶液的一般步骤是计算、称量、溶解、冷却、转移、洗涤、定容。
点评:此题考核了溶液配置的步骤,熟悉实验操作步骤,难度不大。
本题难度:简单
5、选择题 Inorganic Syntheses一书中,有一如下图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是(?)

A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
参考答案:B
本题解析:A、A中装浓硫酸,B中装浓盐酸,这样的操作是方便A中的液体流下,但是因为流下的浓硫酸的量少,不可能一下子全部吸收完浓盐酸中的水分,得不到干燥的纯净气体,错误;B、A中装浓盐酸,B中装浓硫酸,这样当有少量的浓盐酸流下来时,就会被大量的浓硫酸吸收完里面的水份,从而得到干燥的纯净的氯化氢气体,正确;C、A中装氢氧化钠浓溶液,B中装浓氨水,得不到干燥的纯净气体,错误;D、A中装浓氨水,B中装氢氧化钠浓溶液,得不到干燥的纯净气体,错误。
本题难度:一般