|
高考化学试题《电解质溶液中离子浓度大小的比较》试题预测(2019年最新版)(八)
2019-07-04 01:19:05
【 大 中 小】
|
1、选择题 常温下,用0.1000mol/L?HCl溶液滴定?20.00mL?0.1000mol/L?NH3?H2O溶液滴定曲线如图.下列说法正确的是( )
A.点①溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.点②溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.点③溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
| 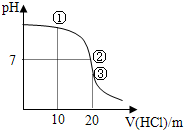
参考答案:A、由图象可知,点①反应后溶液是NH4C1与NH3?H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3?H2O电离程度大于NH4C1的水解程度,故c(NH4+)>c (C1-)>c(OH-)>c(H+),故A错误;
B、由图象可知,点②pH=7,即c(H+)=c(OH-),由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),故c(NH4+)=c(C1-)>c(OH-)=c(H+),故B错误;
C、由图象可知,点③体积相同,则恰好完全反应生成NH4C1,NH4C1水解溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D、当NH3?H2O较多,滴入的?HCl较少时,生成NH4C1少量,溶液中NH3?H2O浓度远大于NH4C1浓度,可能出现c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选D.
本题解析:
本题难度:简单
2、选择题 常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,当溶液中
[? ]
A.c(CH3COO-)=c(Na+)时,该溶液一定呈中性
B.c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全中和
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量
参考答案:A
本题解析:
本题难度:一般
3、选择题 对于0.1mol/L?Na2SO3溶液,正确的是
[? ]
A、升高温度,溶液的pH降低?
B、c(Na+)=2c(SO32-)+?c(HSO3-)+?c(H2SO3)
C、c(Na+)+c(H+)=2?c(SO32-)+?2c(HSO3-)+?c(OH-)
D、加入少量NaOH固体,c(SO32-)与c(Na+)均增大
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol?L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
参考答案:A.NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,c(OH-)>c(H+),故A错误;
B.由溶液呈电中性有电荷守恒关系:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故B错误;
C.根据化学式NaHRO3得物料守恒关系:c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),故C正确;
D.同浓度的两溶液中,c(Na+)相等,c(HRO3-)不一定相等,c(SO32-)>c(CO32-),故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是?
[? ]
A.水的离子积通常用Kw来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大
B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离
C.一定条件下,使用催化剂能加快反应速率且提高反应物的平衡转化率
D.同浓度的Na2CO3、NaNO3、Na2SO3溶液的pH:NaNO3<Na2SO3<Na2CO3
参考答案:D
本题解析:
本题难度:一般
| 