| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》考点特训(2019年冲刺版)(二)
F.定容后使溶液混匀静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线 参考答案:(1)NH3>CO2>O2>Cl2;NH3>O2>CO2>Cl2;(2)12.5g,250mL容量瓶 、烧杯 、玻璃棒;AC。 本题解析:(1)质量相同,设质量为1g,原子个数与原子的物质的量成正比,n(O2)=(2×1)/32mol、n(NH3)=(4×1)/17、n(CO2)=(3×1)/44、n(Cl2)=(2×1)/71,所含原子数目由多到小的顺序:NH3>CO2>O2>Cl2;相同温度和相同压强下,体积与分子物质的量成正比,n(O2)=1/32mol、n(NH3)=1/17mol、n(CO2)=1/44mol、n(Cl2)=1/71mol,体积由多到少的顺序是:NH3>O2>CO2>Cl2;(2)根据n=m/M,m(CuSO4·5H2O)=250×10-3×0.2×250g=12.5g,配制溶液需要的仪器是:250mL容量瓶、托盘天平、烧杯、玻璃棒、胶头滴管,则所用的玻璃仪器用:250mL容量瓶 、烧杯 、玻璃棒;A、部分失去结晶水,所称量的溶质的质量增加,浓度偏高,正确;B、容量瓶中含有少量蒸馏水,对所配浓度无影响,错误;C、未冷却的溶液注入容量瓶中,热胀冷缩,所配的体积减小,浓度增大,正确;D、定容时仰视,所配的体积增大,浓度减小,错误;E、“左码右物”所称物质的质量减小,所配浓度减小,错误;F、立即滴蒸馏水,相当于对所配溶液稀释,浓度减小,错误,则AC正确。 本题难度:一般 4、选择题 在容量瓶上,无需标记的是 |
参考答案:C
本题解析:在容量瓶上标记有温度、容量、刻度线。没有标记浓度的大小。
考点:考查仪器容量瓶的识别。
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为2NA
B.标准状况下,22.4 L O2作氧化剂时转移电子数一定为4NA
C.10 L 0.1 mol·L-1的Na2CO3溶液中,Na+、CO32—总数为3NA
D.通常状况下,4.2 g丙烯中所含碳氢键数目为0.6NA
参考答案:D
本题解析:A项,铜与浓硫酸的反应中,随反应进行硫酸浓度降低,稀硫酸不与铜反应,无法确定转移电子数,错误;B项,金属钠在氧气中燃烧生成过氧化钠,1 mol氧气反应转移2 mol电子,错误;C项忽视了CO32—的水解,错误;4.2 g丙烯中所含碳氢键数目为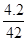 ×6NA=0.6NA,D项正确
×6NA=0.6NA,D项正确
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《认识晶体》.. | |