1、填空题 A与芳香族化合物B在一定条件下反应生成C,进一步反应生成抗氧化剂阿魏酸。
A的相对分子质量是104,1 molA与足量NaHCO3反应生成2 mol气体。已知:
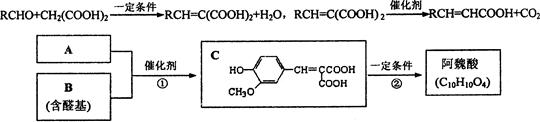
(1)C可能发生的反应是?(填序号)。
a.氧化反应? b.水解反应? c.消去反应? d.酯化反应
(2)等物质的量的C分别与足量的Na、NaHCO3、NaOH反应时消耗Na、NaHCO3、NaOH的物质的量之比是?。
(3)A的分子式是?。
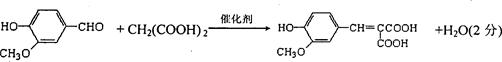
(4)反应①的化学方程式是?。
(5)符合下列条件的阿魏酸的同分异构体有?种,写出其中任意一种的结构简式?。
①在苯环上只有两个取代基;②在苯环上的一氯取代物只有两种;
③1 mol该同分异构体与足量NaHCO3反应生成2 molCO2。
参考答案:
(1)a、d(1分);? (2)3:2:3(1分);? (3)C3H4O4(1分);
(4)
(5)4种(2分)(写出下列四种结构中的任意一种均可得2分)
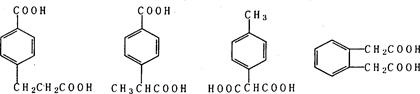
本题解析:
本题考查有机合成与推断。关键在于依据信息找到突破点。依据题目信息及框图变化关系,A的结构为HOOCCH2COOH,相对分子质量为104,则B为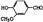 ,故阿魏酸为
,故阿魏酸为 。1 mol该同分异构体与足量NaHCO3反应生成2 molCO2,说明同分异构体有两个羧基,则同分异构体为
。1 mol该同分异构体与足量NaHCO3反应生成2 molCO2,说明同分异构体有两个羧基,则同分异构体为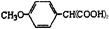 。
。
本题难度:一般
2、填空题 (6分)某含氧有机化合物,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,经红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基,且有三种不同环境的氢原子。
(1)其分子式为______,结构简式为____________。
(2)其同分异构体中与其含有相同官能团的共有___种(不含此有机物,填数字)。
参考答案:
(1) C5H12O,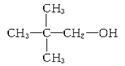 (2)? 7
(2)? 7
本题解析:该有机物中含有的碳原子是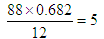 ,含有的氢原子是
,含有的氢原子是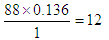 ,所
,所
以含有的氧原子是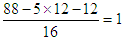 。因此分子式为C5H12O。红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基,且有三种不同环境的氢原子,所以其结构简式为
。因此分子式为C5H12O。红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基,且有三种不同环境的氢原子,所以其结构简式为
 。含有的官能团是羟基,若主链含有5个碳原子,则有3种同分异
。含有的官能团是羟基,若主链含有5个碳原子,则有3种同分异
构体,若主链是4个碳原子,则有4种,再就是题中的结构简式,所以有7种同分异构体。
本题难度:一般
3、实验题 化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。图中所列装置是用燃烧法确定有机物分子式常用的装置。(每一组仪器只能使用一次)


回答下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是_____ 。
(2)C装置中浓硫酸的作用是_____ 。
(3)D装置中MnO2的作用是_____ 。
(4)若准确称取7.2 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加22 g,B管质量增加10.8 g,则该有机物的最简式为_____ 。
(5)要确定该有机物的分子式,则_____ (填“是”或“不”)需要测定其他数据,若能确定其分子式,若其一氯代物只有一种,则其结构简式为_____ 。
参考答案:(1)g→f,e→h,i→c,d→a(2)吸收水分,得到干燥纯净的O2(3)作催化剂,加快产生O2的速率(4)C5H12 (5)不 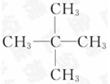
本题解析:据实验目的和各装置的作用推知整套装置为D→C→E→B→A,各导管接口顺序为g→f,e→h,i→c,d→a。其中D为O2发生装置(MnO2作催化剂),C中浓H2SO4作用是吸收水分,得到干燥纯净的O2,E为有机物燃烧装置,B中CaCl2吸收反应生成的H2O,A中NaOH吸收反应生成的CO2。m(CO2)="22" g,n(CO2)="0.5" mol,m(H2O)="10.8" g,则n(H2O)="0.6" mol,则m(C)+m(H)="12×0.5+0.6×2×1=7.2" g,所以该有机物的最简式为C∶H=0.5∶(0.6×2)=5∶12,即C5H12,因最简式中氢原子数已达饱和,故C5H12就是其分子式,若其一氯代物只有一种,则其结构简式为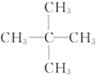 。
。
本题难度:一般
4、选择题 将a mol氢气和b mol乙烯混合,在一定条件下使它们部分反应生成c mol乙烷,将反应后的混合气体完全燃烧,消耗氧气的物质的量为? ( )
A.(3b+0.5a) mol
B.(4b+0.5a) mol
C.(3b+1.5a) mol
D.无法判断
参考答案:A
本题解析:不管如何反应,最后的燃烧产物都是CO2和H2O,而且由于C和H物质的量是固定的,因此O2的物质的量也是固定的混合物中C来自C2H4,物质的量为2b mol
H来自两边,物质的量为(2a+4b) mol
而1mol C燃烧为CO2需1mol O2,1mol H燃烧为H2O需要0.25mol O2
因此O2总物质的量为1×2b+0.25×(2a+4b)="(0.5a+3b)" mol
因此选A
点评:掌握相关化学方程式的计算。
本题难度:一般
5、计算题 (6分)由人尿分离出来的结晶化合物A,熔点为187~188℃。对化合物A做下列实验:
①测得A的蒸气密度为8.Og/L(已折合成标准状况)。
②取17.92gA完全燃烧,生成的气体通过浓硫酸,浓硫酸增重8.10g;剩余气体通过碱石灰,气体质量减少39.60g。
③另取17.92gA完全分解,可得标准状况下氮气1.12L。
试通过计算确定A的分子式。
参考答案:M(A)="8.0g" / L×22.4L / mol="179.2g" / mol(1分)
由题中数据计算知:0.1mol A可产生0.45mol H2O,0.9mol CO2和0.05mol N2(3分)
即1mol A 中含9mol C 9mol H 1mol N
设A的分子式为C9H9NOX
则:9×12+9+14+16x=179.2
∴x=3
∴A的分子式是C9H9NO3?(2分)
(其它合理的解法同样得分)
本题解析:考查有机物分子式的确定及相关计算。
本题难度:一般