| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《原电池原理》考点强化练习(2019年押题版)(二)
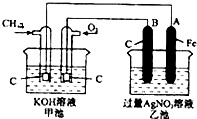 参考答案:A.通入氧气的一极为原电池的正极,发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,故A正确; 本题解析: 本题难度:一般 2、选择题 原电池的反应原理是( ) 参考答案:原电池可将化学能转变为电能,反应原理为氧化还原反应,工作时,负极发生氧化反应,正极发生还原反应. 本题解析: 本题难度:简单 3、填空题 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: 参考答案:(1)①碳 本题解析:(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出;②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH--4e-=2H2O+O2↑;(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,方程式为:②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,2H2O+O2+4e-=4OH-,乙装置中,碳棒是阳极,发生失电子的氧化反应,将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为Cl2+2KI=I2+2KCl;③电解氯化钠溶液的方程式为:2NaCl+2H2O=Cl2↑+H2↑+2NaOH,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=n/V=0.02mol/0.2L=0.1mol/L,故PH等于13。 本题难度:一般 4、选择题 某学习小组为研究电化学原理,设计下图装置。下列叙述正确的是 参考答案:D 本题解析: 本题难度:一般 5、填空题 用铜片和铝片为电极,与电解质溶液构成原电池,回答相关问题? 参考答案:(1)Al?,?Al -3 e- = Al3+?,?2Al +6H+ = 2Al3+ + 3H2↑ 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《硅酸》试题.. | |