1、选择题 25°C下列各组间一定能大量共存的是
A.pH=1的溶液:Na+、CO32-、Cl-、Ca2+
B.水电离的c(H+)=1.0×10-13的溶液:K+、HCO3-、SO42-、NH4+
C.c(OH-)/c(H+)=1.0×10—12的溶液:Fe2+、NO3-、K+、Cl-
D.含有Ba2+离子溶液:AlO2-、Na+、NO3-、NH4+
参考答案:D
本题解析:A中显酸性,CO32-不能大量共存;B中可能显酸性,也可能显碱性,不论溶液显什么性,HCO3-都不能大量共存;C中显酸性,在该环境下NO3-具有强氧化性,Fe2+具有还原性,不能大量共存;答案选D。
本题难度:一般
2、填空题 (6分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Al3+、Fe3+、SO42―、CO32―、Cl―和I―。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,通入过量CO2气体有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据上述实验事实,你可知道该溶液中:
① 肯定含有的离子是?;
② 肯定不存在的离子是 ?;
③ 还不能确定是否存在的离子是 ?。
参考答案:① NH4+、Al3+、I―?②Mg2+、Fe3+、CO32―?③ ?K+、Na+、SO42―、Cl―
本题解析:溶液澄清,故肯定没有Fe3+存在;由(1)知,肯定没有CO32―存在,因为该离子水溶液显碱性;由(2)知,肯定有I―存在;由(3)知,肯定没有Mg2+的存在;由(4)知,肯定有Al3+的存在,通入过量CO2气体时才会双水解产生Al(OH)3白色沉淀;由(5)知,放出的气体为氨气,故溶液一定含有NH4+。由于溶液中有Al3+,故溶液中肯定不能存在CO32―,否则会发生双水解。而K+、Na+、SO42―、Cl―这些离子则不能确定是否存在。
点评:本题涉及到了离子共存问题,需要要学生掌握一些基本的反应以及离子能共存的原理,在解题中注意有些物质的特殊性以及特殊的实验,例如萃取实验。
本题难度:一般
3、选择题 在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO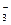 、MnO
、MnO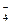
B.K+、Na十、Br-、CO32-
C.Mg2+、Na+、Cl-、SO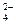
D.Na十、Ba2+、OH-、SO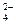
参考答案:C
本题解析:略
本题难度:一般
4、选择题 下列离子在指定溶液中一定能大量共存的是( )
①加入Al能放出H2的溶液中:Na+、K+、N 、Cl-、S2-
、Cl-、S2-
②在pH=1的溶液中:Na+、N 、S2-、S
、S2-、S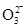
③由水电离的c(H+)=10-12mol/L的溶液中:Cl-、HC 、N
、N 、N
、N 、F-
、F-
④加入Mg能放出H2的溶液中:Mg2+、N 、Cl-、K+、S
、Cl-、K+、S
A.②④
B.④
C.②③
D.①②
参考答案:B
本题解析:选项①中溶液可能显酸性,也可能显碱性。如果显酸性,则在NO3-的存在下,S2-不能大量共存,也不能生成氢气;②中溶液显酸性,则在NO3-的存在下,S2-、S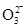 不能大量共存;③中溶液中水的电离是被抑制的,所以溶液可能显酸性,也可能显碱性。由于HC
不能大量共存;③中溶液中水的电离是被抑制的,所以溶液可能显酸性,也可能显碱性。由于HC 既能与酸反应,也和碱反应,所以一定不能大量共存;④中溶液显酸性,一定可以大量共存,答案选B。
既能与酸反应,也和碱反应,所以一定不能大量共存;④中溶液显酸性,一定可以大量共存,答案选B。
本题难度:一般
5、选择题 某无色透明的酸性溶液中能大量共存的一组离子是( )
A.Na+、SO42-、Al3+、Cl-
B.Na+、HCO3-、K+、SO42-
C.MnO4-、K+、SO42-、Na+
D.Fe3+、Na+、SO42-、Cl-
参考答案:A.Na+、SO42-、Al3+、Cl-之间不发生反应,也不与氢离子反应,且都为无色离子,在溶液中能够大量共存,故A正确;
B.HCO3-与氢离子反应,在溶液中不能大量共存,故B错误;
C.MnO4-为紫红色溶液,不满足溶液无色要求,故C错误;
D.Fe3+为有色离子,不满足溶液无色的条件,故D错误;
故选A.
本题解析:
本题难度:一般