1、选择题 关于键长、键能和键角,下列说法中不正确的是
[? ]
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.C=C键的键能等于C-C键键能的2倍
D.因为O-H键的键能小于H-F键的键能,所以O2、F2与H2反应的能力逐渐增强
参考答案:C
本题解析:
本题难度:简单
2、填空题 2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备。请回答下列问题:
(1)O、S、Se的电负性最小的是?,它们的氢化物中沸点由高到低的顺序是?(用化学式表示)。
(2)硒的低价含氧酸盐—亚硒酸钠(Na2SeO3),能促进细胞DNA的增殖活性,延缓细胞衰老,SeO32-中的Se原子杂化方式是?,空间构型为?;
(3)镉(Cd)与锌为同族相邻元素,在周期表中Cd位于?区,Cd 的最外层电子排布图是?。
(4)锌单质晶体是六方最密堆积,原子按?(填“ABABAB”或“ABCABCABC”)的方式堆积而成,晶体中Zn原子的配位数为?,锌易与某些小分子物质形成配合物,在[Zn(NH3)4]2+离子中提供孤电子对的原子是?(填元素符号)。
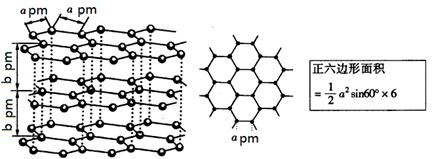
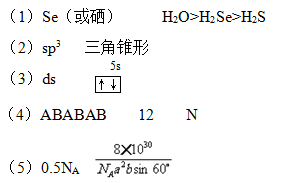
(5)镉和锌都是电的良导体,非金属晶体石墨也具有良好的导电性,下图为石墨晶体结构示意图及提供的资料,12g石墨晶体中正六边形的数目为?,石墨的密度为?g·cm-3。(阿伏加德罗常数为NA)
参考答案:
本题解析:(1)同一主族从上到从非金属逐淅减弱,电负也减弱,Se的电负性最小;H2O分子之间形成氢键,其它分子间是范德华力,因而沸点由高到低排列是H2O、H2Se、H2S。
(2)SeO32-中硒原子中孤电子对数=(6+2-3×2)/2=1,所以Se采取的是sp3杂化,空间构型是三解锥形。
(3)Zn位于第四周期 ⅡB,属于ds区。所以同族的镉位于ds区,最外层电子排布图是 。
。
(4)Zn是六方最密积堆积,ABABAB,晶体中Zn的配位数是12。在[Zn(NH3)4]2+离子中提供孤电子对的原子是N。
(5)在石墨的结构中,一个碳原子归三个六边形所有,所以一个六边形平均点有1/3个碳原子,一个六边形有6个这样的碳原子,故一个六边形平均点有2个碳原子。12g石墨含有六边形是1mol×NA/2=0.5NA。由于由于层与层可滑动,抽象出一个正六棱柱,一个六棱柱体积=1/2(6a2bsin600×10-30)cm3,密度=m/v=[2×12÷NA]÷[1/2(6a2bsin600×10-30)]=8×10-30/NAa2bsin600
本题难度:一般
3、填空题 (12分)现有A、B、C、D、E五种短周期元素,其原子序数依次增大。A、C的基态原子电子排布中未成对电子数与其周期数相等,且A的最外层电子数是次外层电子数的2倍。D的阳离子、C的阴离子均与氖原子的电子层结构相同,且D的单质与C的单质反应能生成D2C和D2C2两种化合物。E所在周期序数比所在主族序数大l。
(1)2011年是国际化学年,其中一项重要活动是纪念居里夫人获诺贝尔化学奖100周年。居里夫妇发现了放射I生镭(Ra)和钋(Po)元素,其中E与镭同主族,镭位于?族。
(2)E的基态原子的核外电子排布式是?,A、B、C三种元素中第一电离能最大的是?,B、c、D的原子半径由小到大的顺序为?(均用元素符号?表示)。
(3)D2C2与AC2反应的化学方程式为?,请写出该反应的一种用?。
(4)B与氢元素形成最简单的气态氢化物的空间构型为?,其中共价键类型为?(填极性键或非极性键)。已知B≡B键能为946 kJ·mol-1,H-H键能为
436 kJ·mol-1,B—H键能为391 kJ·mol-1,则B2和H2反应的热化学方程式为?。
参考答案:(1)IIA(2分)(2)1s22s22p63s2(2分) N(1分)O<N<Na(1分)
(3)2Na2O2+2CO2=2Na2CO3+O2?(2分)供氧(1分)
(4)三角锥(2分)极性键(2分)N2(g)+3H2(g)=2NH3(g);?H="-92" kJ·mol-1
本题解析:A的最外层电子数是次外层电子数的2倍表明A为碳,D的阳离子、C的阴离子均与氖原子的电子层结构相同,表明C、D分别属于第二、三周期,且C的基态原子电子排布中未成对电子数与其周期数相等,说明C为氧,则B为N,根据D的单质与C的单质反应能生成D2C和D2C2两种化合物知D为钠,E原子序数D大且为短周期,则E在第三周期,IIA为镁(E所在周期序数比所在主族序数大l),碳、N、氧的第一电离能最大的是N(N原子的2p轨道处于半充满,为稳定结构),根据同周期原子半径由左向右越来越小,同主族原子半径由上到下越来越大,B、c、D的原子半径由小到大的顺序为O<N<Na,B与氢元素形成最简单的气态氢化物为NH3,由不同种原子形成的共价键为极性键,B2和H2反应时,断键吸热:946+3х436=2254 kJ,成键放热:6х391=2346kJ,则反应放热92 kJ热化学方程式为N2(g)+3H2(g)=2NH3(g);?H="-92" kJ·mol-1。
本题难度:一般
4、选择题 使用微波炉加热,具有使受热物质均匀受热、表里一致、速度快、热效率高等优点。其工作原理是通电后炉内的微波场以几亿赫兹的高频改变外电场的方向,水分子因而能迅速摆动,产生热效应,这是因为
[? ]
A.水分子具有极性共价键
B.水分子中有共用电子对
C.水由氢、氧两元素组成
D.水分子是极性分子
参考答案:D
本题解析:
本题难度:简单
5、选择题 主族元素W、X、Y、Z位于同一周期,原子序数依次增大,.Y、Z是非金属元素.W、X的最高价氧化物对应的水化物可以相互反应,W与Y可形成化合物W2Y,Y的最外层电子数是核外电子层数的2倍.下列说法正确的是( )
A.Y的气态氧化物比Z的气态氢化物稳定
B.W的最高价氧化物对应的水化物是已知最强的碱
C.Y单质和氧气、氢气都能发生化合反应,且产物都具有还原性
D.W、X、Y、Z四种元素的原子半径由小到大的顺序是:W<X<Y<Z
参考答案:W、X是金属元素,W、X的最高价氧化物对应的水化物应为碱,可以相互反应,说明一种为两性氧化物,应为Al(OH)3,则W为Na,X为Al,Y的最外层电子数是核外电子层数的2倍,且与Na、Al在同一周期,应为S元素,Z的原子序数最大,主族元素,只有Cl元素符合,则
A.非金属性Y<Z,Z的气态氢化物稳定,故A错误;
B.W为Na,对应的碱不是最小的碱,最强的碱应是金属性最强的金属,位于周期表左下角,为Cs,故B错误;
C.S单质和氧气、氢气都能发生化合反应,分别生成二氧化硫、硫化氢,二者具有还原性,故C正确;
D.同周期元素从左到右原子半径逐渐减小,应有W>X>Y>Z,故D错误.
故选C.
本题解析:
本题难度:简单