1、选择题 下列离子方程式正确的是(?)
A.碳酸钙和盐酸反应: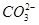 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
B.向氢氧化钡溶液中加硫酸溶液:Ba2++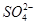 =BaSO4↓
=BaSO4↓
C.向氯化铜溶液中加铁粉:Cu2++Fe=Cu+Fe2+
D.向稀盐酸溶液中加铁:2Fe+6H+=2Fe3++3H2↑
参考答案:C
本题解析:A项中碳酸钙不应拆分;B项中生成物水也不能拆分;D项中生成物与事实不符,因为氢离子只能将铁氧化为亚铁。
本题难度:简单
2、选择题 下列反应的离子方程式正确的是( )
A.小苏打与盐酸反应:HCO3-+H+═CO2↑+H2O
B.氯气与水反应:Cl2+H2O═2H++Cl-+ClO-
C.氢氧化钡溶液和稀硫酸反应:Ba2++SO42-═BaSO4↓
D.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+
参考答案:A.小苏打与盐酸反应生成二氧化碳和水,其离子方程式为:HCO3-+H+═CO2↑+H2O,故A正确;
B.次氯酸为弱酸部分电离,在离子方程式中要写成分子形式,则氯气与水反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,故B错误;
C.氢氧化钡溶液和稀硫酸反应为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故C错误;
D.FeCl3溶液与铜反应生成铜离子和亚铁离子,所以用FeCl3溶液腐蚀铜线路板,其离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,故D正确.
故选AD.
本题解析:
本题难度:一般
3、选择题 铬(Cr)属于重金属元素,含铬的废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬原子核中质子数为24,铬位于周期表中第______周期。
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。已知:

①FeSO4还原Cr2O72-的离子方程式为______________________________________________。
②Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为_____________________。
③沉淀法分离废水中的Cr3+,pH应控制的范围是________。
④下列关于铬及其化合物的说法中正确的是________。
A.K2Cr2O7是一种常用的强氧化剂
B.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
C.金属铬硬度大、耐腐蚀,是常用的镀层金属
参考答案:(1)四
(2)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
②Cr3++4OH-=CrO2-+2H2O
③8~10 ④ABC
本题解析:(1)铬为24号元素,位于元素周期表的第四周期。
(2)①Fe2+被氧化为Fe3+,Cr2O72-被还原为Cr3+,注意反应是在酸性条件下进行的;
②根据已知反应:
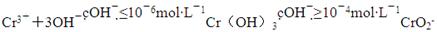
可知,Cr3+与过量NaOH反应产物为CrO2-;
③根据提供的c(OH-)可知应控制pH的范围为8~10;
④K2Cr2O7中Cr的化合价为最高价(+6价),所以氧化性强;酸性K2Cr2O7可氧化酒精,出现颜色变化。
本题难度:一般
4、选择题 下列离子方程式书写正确的是( )
A.用氨水吸收少量SO2气体:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
C.NH4HCO3溶液与过量的NaOH溶液反应:NH4++OH-=NH3↑+H2O
D.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
参考答案:A
本题解析:略
本题难度:一般
5、选择题 把Ba(OH)2溶液滴入KAl(SO4)2溶液中,使Al3+刚好全部转化成Al(OH)3沉淀时,溶液中离子浓度最大的是(?)
A.Ba2+
B. K+
C.SO42-
D.OH-
参考答案:B
本题解析:然后设硫酸铝钾的物质的量是1mol,则把Ba(OH)2溶液滴入KAl(SO4)2溶液中,使Al3+刚好全部转化成Al(OH)3沉淀时,消耗氢氧化钡的物质的量是1.5mol,此时生成1.5mol硫酸钡,剩余0.5mol SO42-,而溶液中的K+是1mol,所以溶液中离子浓度最大的是K+,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题的考查,试题综合性强,贴近高考,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确反应的原理,然后依据方程式直接列式计算即可。
本题难度:一般