1、计算题 Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
阴离子
| SO42-、NO3-、Cl-
|
阳离子
| Fe3+、Fe2+、NH4+、Cu2+、Al3+
|
?
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是?。
(2)原溶液中含有的阳离子是?。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为?。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为?。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
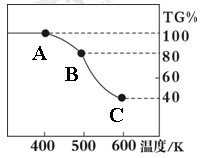
(5)草酸亚铁晶体中碳元素的化合价为:?
(6)A→B发生反应的化学方程式为?。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为:?;释放第二种气体时,反应的化学方程式为?。
参考答案:(16分,每空2分)(1)溶液呈红色(2分)?(2)Fe2+、Cu2+?(2分);
(3)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O(2分)?(4)160.0g(2分)(写成160g不给分);
(5)+3(2分)?(6)FeC2O4·2H2O FeC2O4 +2H2O(2分)
FeC2O4 +2H2O(2分)
(7)CO(2分)? FeCO3 FeO +?CO2↑(2分)
FeO +?CO2↑(2分)
本题解析:Ⅰ.若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和具有还原性的Fe2+。若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-。各离子的物质的量均为1mol,因此根据电荷守恒可知还应含有Cu2+,所以原溶液中所含阳离子是Fe2+、Cu2+,阴离子是NO3-、Cl-、SO42-。
(1)如果先加入盐酸,在酸性条件下NO3-具有氧化性,能和具有还原性的Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。所以再滴入KSCN溶液,溶液呈红色。
(2)原溶液中含有的阳离子是Fe2+和Cu2+。
(3)根据以上分析可知,向原溶液中加入足量的盐酸,发生反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。
(4)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,最终得到的固体应该是是CuO、Fe2O3。根据题意各离子的物质的量均为1mol可知,m(CuO)=1.0mol×80g/mol=80.0g,m(Fe2O3)=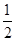 ×1.0mol×160g/mol=80.0g,所得固体的质量为80.0g+80.0g=160.0g。
×1.0mol×160g/mol=80.0g,所得固体的质量为80.0g+80.0g=160.0g。
Ⅱ.(5)草酸亚铁晶体(FeC2O4·2H2O)中铁元素的化合价是+2价,氧元素是-2价,所以碳元素的化合价是(2×4-2)÷2=+3价。
(6)根据草酸亚铁晶体的化学式FeC2O4·2H2O可知,晶体中结晶水的含量是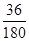 ×100%=20%,所以A→B发生反应恰好是失去结晶水,因此反应的化学方程式为FeC2O4·2H2O
×100%=20%,所以A→B发生反应恰好是失去结晶水,因此反应的化学方程式为FeC2O4·2H2O FeC2O4 +2H2O。
FeC2O4 +2H2O。
(7)草酸亚铁晶体中FeO的含量是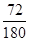 ×100%=40%,所以C点生成的固体是氧化亚铁。由于第二步释放的气体的相对分子质量较第一步的大,所以第一步释放的是CO,第二步释放的是CO2,反应的化学方程式分别是FeC2O4
×100%=40%,所以C点生成的固体是氧化亚铁。由于第二步释放的气体的相对分子质量较第一步的大,所以第一步释放的是CO,第二步释放的是CO2,反应的化学方程式分别是FeC2O4 FeCO3+CO、FeCO3
FeCO3+CO、FeCO3 FeO +?CO2↑。
FeO +?CO2↑。
本题难度:困难
2、选择题 下列各组离子一定能大量共存的是( )
A.含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol?L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
参考答案:A.Fe3+、SCN-离子之间结合生成络离子,则不能共存,故A错误;
B.该组离子之间不反应,能共存,故B正确;
C.在c(H+)=10-13mol?L-1的溶液,显碱性,NH4+、Al3+分别与OH-反应,则不能共存,故C错误;
D.pH=1的溶液,显酸性,H+、Fe2+、NO3-离子之间发生氧化还原反应,则不能共存,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 下列各组离子能在溶液中大量共存,且溶液呈碱性、透明的是 (? )
A.Na+、OH-、H2PO4-、NO3-
B.[Al(OH)4]-、K+、CO32-、Na+
C.Al3+、Cl-、CO32-、Na+
D.Fe2+、K+、H+、NO3-
参考答案:B
本题解析:A中OH-与H2PO4-生成HPO42-或PO43-不能大量共存; C中Al3+与CO32-发生双水解反应不能大量共存;D中Fe2+、H+、NO3-发生氧化还原反应不能大量共存。
点评:H2PO4-以电离为主,显酸性。
本题难度:一般
4、选择题 在水溶液中能大量共存的一组离子是
A.Na+、Ba2+、Cl—、NO3—
B.Pb2+、Hg2+、S2—、SO42—
C.NH4+、H+、S2O32—、PO43—
D.Ca2+、Al3+、Br—、CO32—
参考答案:A
本题解析:B.Pb2+和Hg2+与S2—反应生成难溶物,Pb2+与SO42—反应生成难溶物;C. H+与S2O32—反应生成S和SO2; D.Ca2+与CO32—生成沉淀;Al3+与CO32—在水中双水解反应。
本题难度:一般
5、选择题 下列表述正确的是?(?)
A.碳酸氢钠溶液的水解反应: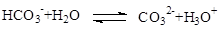
B.用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O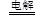 2OH-+H2↑+Cl2
2OH-+H2↑+Cl2
C.氢硫酸的电离方程式:H2S=2H++S2-
D.向氢氧化镁饱和溶液中滴加氯化铁溶液,出现红褐色沉淀
参考答案:D
本题解析:A项是CO32-的电离,B项Mg2+不能与OH-大量共存,所以应该生成Mg(OH)2,C项多元弱酸的电离是分步的,D项正确,答案选D。
点评:本题主要考查化学基本概念,比较简单基础。
本题难度:简单