|
高考化学知识点归纳《化学实验的基本操作》高频试题巩固(2019年最新版)(二)
2019-07-04 01:41:24
【 大 中 小】
|
1、填空题 (16分)(1)配制物质的量浓度为0.2 mol/L的NaOH溶液500 mL,填空并请回答下列问题:
应称量NaOH的质量/g
| 已给仪器
| 除已给仪器外还需要的其他仪器
| ?
| 烧杯、药匙、
托盘天平
| ?
|
(1)
(2)下列操作对配制的NaOH溶液浓度有偏高影响的是_______?
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
| (3)当向0.2 mol/L NaOH的溶液通入一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①______?_,②?,? ③______?__,? ④?。
(4)向0.1 mol/L的AlCl3溶液中加入过量的0.2 mol/L的NaOH溶液,则发生反应的离子方程式为?。
参考答案:(1)4.0(2分)(答4的给1分);500 mL容量瓶、玻璃棒、胶头滴管、量筒(2分)(容量瓶不写规格不给分,写错别字不给分)
(2)C(2分)
(3)NaOH和Na2CO3 ,Na2CO3?,Na2CO3和NaHCO3?,NaHCO3?
(4)Al3+ + 4OH— = AlO2— + 2H2O(2分)
本题解析:略
本题难度:一般
2、填空题 粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质。工业上以粗氧化锌生产硫酸锌晶体(ZnSO4·7H2O)的工艺流程如下图所示:

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
请回答下列问题:
(1)操作③的名称是?;
(2)加入适量锌粉的作用为?;
(3)加入30%H2O2反应的离子方程式是?;
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ? ,Ca(OH)2不能过量的原因是 ? 。
参考答案:(共14分)
(1)蒸发浓缩、冷却结晶、过滤干燥(每个1分,共3分)。
(2)使溶液中的Fe3+转化为Fe2+(2分);除去Cu2+(2分)
(3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O (3分)
(4)c3(H+)/c(Fe3+) (2分); 防止生成Zn(OH)2(2分)
本题解析:ZnO(CuO、Fe3O4、SiO2)在反应1中SiO2不与H2SO4,过滤(操作①)后得到含Fe3+、Zn2+、Fe2+、H+、SO42-溶液,加入适量锌粉2Fe3++Zn= 2Fe2+ +Zn2+、Cu2++ Zn= Cu +Zn2+,过滤(操作②)后Zn2+、Fe2+、SO42-溶液,加入30%H2O2使Fe2+转化为Fe3+,加入适量Ca(OH)2调节溶液pH,使Fe3+沉淀,可得Zn SO4溶液。
从ZnSO4溶液得到硫酸锌晶体(ZnSO4·7H2O)应经过蒸发浓缩、冷却结晶、过滤干燥。
锌粉可以发生2Fe3++Zn= 2Fe2+ +Zn2+、Cu2++ Zn= Cu +Zn2+的反应。
结合题中信息2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O。
由Fe3+ +3H2O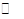 Fe (OH)3+3H+?K= c3(H+)/c(Fe3+);当Ca(OH)2过量使溶液呈碱性时Zn2+会完全生成Zn(OH)2沉淀。 Fe (OH)3+3H+?K= c3(H+)/c(Fe3+);当Ca(OH)2过量使溶液呈碱性时Zn2+会完全生成Zn(OH)2沉淀。
本题难度:一般
3、实验题 ⑴下列实验操作或对实验事实的叙述正确的是?(填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“吱吱”的响声;
③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
⑤蒸发NaCl溶液以得到NaCl固体时,不必将溶液蒸干;
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
⑦如图,可观察到灵敏检流计的指针偏转;

⑧向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶?液的现象相同。
⑵现有0.1mol·L-1的纯碱溶液,用pH试纸测定该溶液的pH,其
正确的操作是?
?
你认为该溶液pH的范围一定介于?之间。请你设计一个简单的实验方案证明纯碱溶液呈碱性是由CO32-引起的:?。
参考答案:⑴②、④、⑤、⑦?
⑵把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH? 7到13?向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去。说明纯碱溶液呈碱性是由CO32-引起的
本题解析:略
本题难度:简单
4、选择题 有下列实验操作,其中正确的是
A.把鼻孔凑到集气瓶口去用力猛闻有毒的气体的味道
B.将取液后的胶头滴管平放在实验台上
C.将浓硫酸倒入盛有水的容量瓶中使其稀释
D.可以用向上排空气法收集密度比空气大的气体
参考答案:D
本题解析:
本题难度:困难
5、选择题 下列有关实验操作,不正确的是 (?)? (?)?
A.抽滤或吸滤属于减压过滤,不适合胶状沉淀与水的分离
B.为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁
C.做银镜反应实验后,试管内壁上的附着物用浓氨水洗涤
D.用纸层析法分离Fe3+、Cu2+时,滤纸上的水做固定相,氨气做显色剂
参考答案:C
本题解析:略
本题难度:简单
|