1、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
[? ]
?
实验操作
实验目的或结论
A.
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
?说明该钾盐是K2CO3
B.
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
?除去MgCl2溶液中少量FeCl3
C.
常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
说明常温下Ksp( BaCO3)< Ksp( BaSO4)
D.
?C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液
检验制得气体是否为乙烯
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列各组仪器常用于物质分离的是
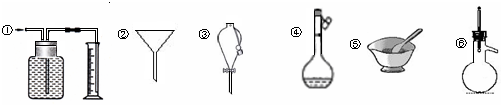
A.①③⑥
B.②③⑥
C.②④⑥
D.②③⑤
参考答案:B
本题解析:①为量气装置,不能用于分离;②为普通漏斗,可用于过滤分离;③为分液漏斗,可用于萃取、分液操作;④为容量瓶,可用于配制一定物质的量浓度的溶液;⑤为研钵,用来研磨固体药品;⑥为蒸馏烧瓶,可用来蒸馏分离沸点不同的液体,则能用来分离的有②③⑥,故选B。
本题难度:简单
3、实验题 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成填空:
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→?→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量?g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、?、?。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验编号
| NaOH溶液的浓度(mol/L)
| 滴定完成时, NaOH溶液滴入的体积(mL)
| 待测盐酸溶液的体积(mL)
|
1
| 0.10
| 22.62
| 20.00
|
2
| 0.10
| 22.72
| 20.00
|
3
| 0.10
| 22.80
| 20.00
|
?
①滴定达到终点的标志是?。
②根据上述数据,可计算出该盐酸的浓度约??(保留两位有效数字)。
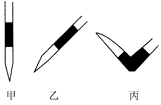
③排去碱式滴定管中气泡的方法应采用如图所示操作中的?(选择甲、乙、丙之一),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:?。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外。
E.碱式滴定管尖嘴部分有气泡,滴定后消失
参考答案:(1)①定容?②0.4?烧杯(或表面皿)药匙
(2)①最后一滴NaOH溶液加入,溶液由无色恰好变成粉红色?②0.11 mol/L?③丙 ④? DE
本题解析:试题分析:(1)①配制一定体积一定物质的量浓度的溶液的操作步骤是计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→ 摇匀→ 装瓶 →贴签。②n(NaOH)=" 0.100" L ×0.10 mol/L=0.01mol.m(NaOH)=0.01mol×40g/mol=0.4g.因此要称量0.4gNaOH. 所需仪器有:天平(带砝码、镊子)烧杯、药匙。(2)①由于是用已知浓度的碱滴定未知浓度的酸,所以指示剂在酸溶液中,当滴定达到终点时会看到溶液由无色变为红色,且半分钟内不褪色即可确定滴定达到了终点。②V(NaOH)= (22.62+22.72+22.80)ml÷3=22.71ml.因为HCl恰好反应时物质的量的比为1:1.所以c(HCl)=" (" 0.10 mol/L×22.71ml)÷20.00ml=" 0.11" mol/L. ③ 排去碱式滴定管中气泡的方法应采用如图所示操作中的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。④A.滴定终点读数时俯视读数,读数偏小,则溶液的体积就偏小。计算出待测溶液的浓度就偏低。错误。B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗。则待测盐酸溶液的物质的量就偏少,滴定时消耗的标准溶液的体积偏小,计算出待测溶液的浓度就偏低。错误。C.锥形瓶水洗后未干燥。不会影响实验测定结果。错误。D.滴定过程中,有少量标准液溅出锥形瓶外。为了将待测溶液进行滴定,就要多滴加标准溶液,标准溶液体积偏大,由此计算出待测溶液的浓度就偏高。正确。E.碱式滴定管尖嘴部分有气泡,滴定后消失。开始读数偏小,后来读数偏小,则消耗的标准溶液的体积就偏多,由此计算出待测溶液的浓度就偏高。正确。
本题难度:一般
4、实验题 (7分)试回答下列(1)、? (2)两小题
(1)白磷的着火点为40℃,在室温或夏天正常取出时,就可观察到其被氧化而冒”白烟”,请简单说明将如何将大块的白磷切变成小块的白磷。
(2)某学生在实验报告中写出以下的实验操作或实验数据,你认为合理的是 (填代号A、B……)
A.用托盘天平称取29.25g的食盐;
B.将浓硫酸沿容器器壁缓缓地倒入酒精中,并不断搅拌;
C.用酸式滴定管量取已知浓度的KMn04溶液20.00mL;
D.用湿润的pH试纸测得某溶液的pH为10
E.做中和滴定实验时,锥形瓶用待测液润洗
参考答案:用镊子夹取白磷,在盛有水的水槽中切割(其它合理答案同样给分)
(2)? BC(4分:只选一个得2分,选两个且都正确得4分,多选不得分)
本题解析:(1)白磷极易自燃,所以正确的操作应该是用镊子夹取白磷,在盛有水的水槽中切割。
(2)托盘天平只能读数到0.1g,A不正确;浓硫酸的密度大于酒精的,所以选项B正确;高锰酸钾溶液具有强氧化性,所以应该用酸式滴定管量取,C正确;pH试纸在检测溶液的pH值时,试纸不能事先润湿,D不正确;中和滴定实验中,锥形瓶不能用标准液润洗,E不正确,答案选BC。
本题难度:一般
5、选择题 下列是一些实验操作的示意图,其中不正确的是?

A?B?C?D
参考答案:B
本题解析:A、给液体加热时,试管内液体不能超过其体积的1/3,防止沸腾溅出;试管与桌面成约45°角,故A正确;
B、用胶头滴管滴加液体时,滴管不可伸入试管内,否则会污染药品,故B错误;
C、取用粉末状或小颗粒状的药品时先将试管横放,把盛药品的药匙或纸槽小心地送入试管底部,再使试管直立,故C正确;
D、取用液体时试剂瓶瓶口要紧挨试管口,防止液体流出;标签向着手心,防止液体流出腐蚀标签;瓶塞倒放桌面上,防止污染瓶塞,从而污染药品.故D正确。
故选B。
点评:本题主要了解各操作的注意事项;掌握常用仪器胶头滴管、掌握加热液体的方法,取用粉末状或小颗粒状的药品和液体的注意事项。
本题难度:简单