1、填空题 已知某溶液中只存在OH-、H+、NH、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH)>c(H+)>c(OH-)? ②c(NH)>c(OH-)>c(Cl-)>c(H+)
③c(NH)>c(Cl-)>c(OH-)>c(H+)? ④c(Cl-)>c(H+)>c(NH)>c(OH-)
填写下列空白
(1)若溶液中只溶解一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为(填序号)________;
(2)若四种离子的关系符合④,则溶质为________;
(3)则pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下列图像正确的是(填图像符号)________;
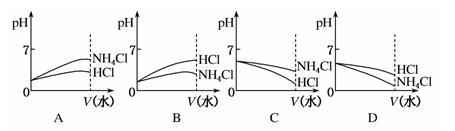
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)
参考答案:(1) NH4Cl ①?(2)HCl? NH4Cl?(3)B?(4) 小于
本题解析:略
本题难度:简单
2、选择题 常温下,在 ?溶液中逐滴加入
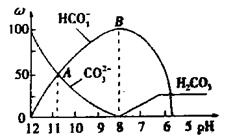
?溶液中逐滴加入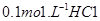 溶液20mL, 溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如右图所示(CO2因逸出未画出),下列说法正确的是
溶液20mL, 溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如右图所示(CO2因逸出未画出),下列说法正确的是
A.在0.1mo1/L Na2CO3溶液中: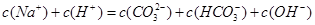
B.当溶液pH为7时,溶液的总体积为20mL
C.在B点所示的溶液中,阳离子浓度最大的是Na
D.在 A点所示的溶液中:
参考答案:CD
本题解析:A不正确,不符合电荷守恒,应该是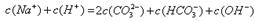 ;如果盐酸是10ml,则恰好生成碳酸氢钠,溶液应该是显碱性的,B不正确;B点对应的是碳酸氢钠,阳离子浓度最大的是是钠离子,C正确;A点碳酸钠和碳酸氢钠的物质的量相同,溶液显碱性,正确,答案选CD。
;如果盐酸是10ml,则恰好生成碳酸氢钠,溶液应该是显碱性的,B不正确;B点对应的是碳酸氢钠,阳离子浓度最大的是是钠离子,C正确;A点碳酸钠和碳酸氢钠的物质的量相同,溶液显碱性,正确,答案选CD。
本题难度:简单
3、选择题 在t℃时某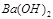 的稀溶液中
的稀溶液中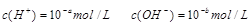 已知
已知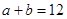 向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示
向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示
混合溶液的部分PH
?
| 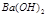 溶液体积/ml 溶液体积/ml
| 盐液的体积/ml
| 溶液的PH
|
①
| 22.00
| 0.00
| 8
|
②
| 22.00
| 18.00
| 7
|
③
| 22.00
| 22.00
| 6
|
假设溶液混合前后的体积变化忽略不计,则c的数值为(?)
A. 3? B. 4? C. 5? D. 6
参考答案:B
本题解析:由于a+b=12,所以在该温度下中性溶液中pH=6,由①可知,氢氧化钡溶液中OH-的浓度是0.0001mol/L,所以根据③可知盐酸溶液中氢离子的浓度也是0.0001mol/L,所以pH=4,答案选B。
本题难度:一般
4、选择题 17.1%的蔗糖溶液200g,加适量的水稀释到5L,求稀释后的蔗糖溶液的物质的量浓度(蔗糖相对分子质量为342)?
A.0.2 mol·L-1
B.0.3 mol·L-1
C.0.02 mol·L-1
D.0.1 mol·L-1
参考答案:C
本题解析:略
本题难度:简单
5、计算题 (1)25℃时, 0.05mol/LH2SO4溶液的PH=________;0.05mol/LBa(OH)2溶液PH=?;
(2)已知100℃时,KW=1×10-12在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH=?。
参考答案:(1)? 1? 13? (2)? 8
本题解析:(1)0.05mol/LH2SO4溶液中氢离子浓度为0.1mol/L,pH=1;25℃时0.05mol/LBa(OH)2溶液中氢氧根离子浓度为0.1mol/L,氢离子浓度为10-13mol/L,pH=13。
(2)100℃时,0.001 mol/L的NaOH溶液中氢氧根离子浓度为0.001mol/L,稀释到1L,氢氧根离子浓度为0.0001mol/L,氢离子浓度为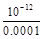 ?mol/L =10-8mol/L,pH=8。
?mol/L =10-8mol/L,pH=8。
点评:计算碱溶液pH时利用c(H+)= 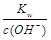 ,再求pH。
,再求pH。
本题难度:一般