1、选择题 下列几种离子化合物中,阴、阳离子间的静电作用最强的是
[? ]
A.KCl
B.NaCl
C.AlF3
D.Na2S
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列有关化学表述正确的是( )
A.羟基的电子式:
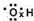
B.次氯酸的电子式
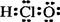
C.核内有8个中子的碳原子:68C
D.乙酸分子的比例模型:

参考答案:A、羟基中氧原子还有一个未成对的单电子,电子式为:
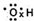
,故A正确;
B、次氯酸中的共价键有氢氧键和氯氧键,氧原子应该放在中间位置,故B错误;
C、原子表示法中,左上角的数为质量数,左下角的数为质子数,质量数-质子数=中子数,所以中子数为8的碳原子中,左上角的数为14,左下角的数为6,故C错误;
D、图示的为乙酸的球棍模型,不是比例模型,故D错误.
故选A.
本题解析:
本题难度:一般
3、选择题 下列叙述中,不正确的是( )
A.离子化合物中也可能存在共价键
B.共价化合物中也可能存在离子键
C.阴离子中也可能存在金属元素
D.离子化合物也可能没有金属元素
参考答案:B
本题解析:
本题难度:简单
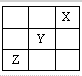
4、选择题 短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是( )
A.Y的原子半径比Z的小
B.Y的氢化物的稳定性比Z的弱
C.Y的最高正化合价为+7
D.X、Y、Z三种元素中,X的非金属性最强
参考答案:三种元素在短周期中的不同周期,则X一定 位于第一周期,且在周期表的右侧,则一定为He,根据其它两种元素的相对位置可知Y为F元素,Z为S元素,
A.Y有2个电子层,Z有3个电子层,电子层越多,原子半径越大,则Y的原子半径比Z的小,故A正确;
B.非金属性Y>Z,则Y的氢化物的稳定性比Z的强,故B错误;
C.Y为F元素,只有0和负价,没有正价,故C错误;
D.X为He,不活泼,Y为F,则X、Y、Z三种元素中,Y的非金属性最强,故D错误;
故选A.
本题解析:
本题难度:一般
5、选择题 下列分子或离子的空间构型为平面三角形的是
A.SiH4
B.H3O+
C.SO32-
D.NO3-
参考答案:D
本题解析:立体构型为平面三角形的分子应含有3个δ键,且没有孤对电子,中心原子为sp2杂化,据此将进行解答。A、Si原子形成4个δ键,根据价层电子对互斥理论可知孤对电子数=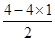 =0,所以为sp3杂化,立体构型为正四面体,因此A不选;B、O原子形成3个δ键,孤对电子数=
=0,所以为sp3杂化,立体构型为正四面体,因此A不选;B、O原子形成3个δ键,孤对电子数=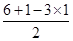 =1,所以为sp3杂化,立体构型为三角锥型,故B不选;C、S原子形成3个δ键,孤对电子数=
=1,所以为sp3杂化,立体构型为三角锥型,故B不选;C、S原子形成3个δ键,孤对电子数=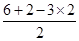 =1,所以为sp3杂化,立体构型为三角锥型,故C不选;D、N原子形成3个δ键,孤对电子数=
=1,所以为sp3杂化,立体构型为三角锥型,故C不选;D、N原子形成3个δ键,孤对电子数=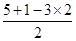 =0,所以中心原子为sp2杂化,立体构型为平面三角形,故D正确,答案选D。
=0,所以中心原子为sp2杂化,立体构型为平面三角形,故D正确,答案选D。
本题难度:一般