1、选择题 下列叙述中正确的是(?)
A.1 mol氢的质量是1 g
B.1 mol CO的质量为28 g·mol-1
C.阿伏加德罗常数等于6.02×1023
D.3.01×1023个SO2分子约是0.5 mol
参考答案:D
本题解析:A中1 mol氢指代不明,无法计算; B、1 mol CO的质量为28 g;C、阿伏加德罗常数约等于6.02×1023个; D、3.01×1023个SO2分子约是0.5 mol正确。
本题难度:一般
2、填空题 Ⅰ.有以下几种物质:①食盐晶体 ②乙醇 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体)
⑥KNO3溶液 ⑦熔融的氢氧化钠 ⑧液态氯化氢 填空回答(填序号):
(1)物质中构成的微粒只能在固定位置上振动的是 ;(2)以上物质可以导电是 ;
(3)以上物质中属于电解质的是 ; (4)以上物质中属于非电解质是 。
Ⅱ.(1)O2、SO2、SO3三者质量之比为1∶2∶5,则它们的氧原子数之比为 。
(2)某金属氯化物MCl2 40.5 g中含有0.6 mol Cl-,则MCl2的摩尔质量为 ,金属M的相对原子质量为 。(3)在V LFe2(SO4)3溶液中含有m g Fe3+,则CFe3+为_______________;从中取出V/4L溶液,则SO42-物质的量浓度为_______________;再将这V/4L溶液溶液稀释到4L,稀释后溶液中溶质的物质的量浓度为___________________。
参考答案:Ⅰ(1)①④⑤;(2)③⑥⑦;(3)①⑤⑦⑧;(4)②④
Ⅱ.(1)1:1:3 (2)135g/mol 64 (3) m/56V mol/L;3m/112V mol/L;m/1792 mol/L
本题解析:Ⅰ、(1)组成物质的微粒之间存在相互作用,各微粒之间既有相互吸引力,又有相互排斥力,当微粒距离较近时,排斥力的作用明显,将微粒推开,当微粒距离较大时,吸引力的作用明显,将微粒拉近,所以通常微粒在较平衡的位置上做极小的运动,即只能在各自平衡位置附近做微小振动,选①④⑤;(2)含有自由移动离子或电子的物质能导电,③水银 中含有自由的电子,所以能导电,⑥KNO3溶液、⑦熔融的氢氧化钠中含有自由移动的离子,所以能导电,选③⑥⑦;(3)①食盐晶体、⑤纯醋酸、⑦熔融的氢氧化钠、⑧液态氯化氢溶于水都能导电,且都是化合物,所以都是电解质,选①⑤⑦⑧;(4)②乙醇和④蔗糖在水溶液里或熔融状态下都以分子存在,所以都是非电解质,选②④。
Ⅱ.(1)根据n=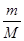 =
=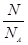 可知,O2、SO2、SO3三者质量之比为1:2:5,则O2、SO2、SO3的物质的量之比为:
可知,O2、SO2、SO3三者质量之比为1:2:5,则O2、SO2、SO3的物质的量之比为: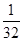 :
: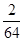 :
: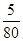 =1:1:2,它们的氧原子数之比为:1×2:1×2:2×3=1:1:3;(2)金属氯化物MCl2,40.5g中含有0.6mol Cl-,则40.5gMCl2的物质的量为:0.6mol×
=1:1:2,它们的氧原子数之比为:1×2:1×2:2×3=1:1:3;(2)金属氯化物MCl2,40.5g中含有0.6mol Cl-,则40.5gMCl2的物质的量为:0.6mol×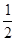 =0.3mol,则MCl2的摩尔质量为:
=0.3mol,则MCl2的摩尔质量为: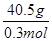 =135g/mol;M的相对原子质量为:135-35.5×2=64;(3)在V LFe2(SO4)3溶液中含有mg Fe3+,铁离子的物质的量为:
=135g/mol;M的相对原子质量为:135-35.5×2=64;(3)在V LFe2(SO4)3溶液中含有mg Fe3+,铁离子的物质的量为: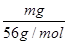 =
=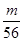 mol,铁离子的物质的量浓度为:c(Fe3+)=
mol,铁离子的物质的量浓度为:c(Fe3+)=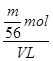 =
=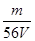 mol/L;该溶液中硫酸根离子浓度为:c(SO42-)=
mol/L;该溶液中硫酸根离子浓度为:c(SO42-)=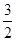 c(Fe3+)=
c(Fe3+)=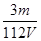 mol/L,溶液具有均一性,则从中取出
mol/L,溶液具有均一性,则从中取出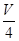 L溶液中SO42-物质的量浓度仍然为
L溶液中SO42-物质的量浓度仍然为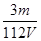 mol/L;再将这
mol/L;再将这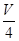 L溶液溶液稀释到4L,稀释过程中溶质的物质的量不变,稀释前Fe2(SO4)3的物质的量浓度为:c[Fe2(SO4)3]=
L溶液溶液稀释到4L,稀释过程中溶质的物质的量不变,稀释前Fe2(SO4)3的物质的量浓度为:c[Fe2(SO4)3]= 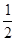 c(Fe3+)=
c(Fe3+)=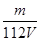 mol/L,则稀释后Fe2(SO4)3溶液中溶质的物质的量浓度为:c[Fe2(SO4)3]=
mol/L,则稀释后Fe2(SO4)3溶液中溶质的物质的量浓度为:c[Fe2(SO4)3]= 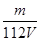 mol/L×
mol/L×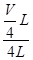 =
=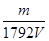 mol/L。
mol/L。
考点:考查电解质、非电解质,物质的导电性,阿伏加德罗定律及推导。
本题难度:一般
3、选择题 已知NA代表阿伏加德罗常数,下列说法正确的是
A.34 g H2O2中含有的阴离子数为NA
B.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
C.1mol重甲基(-CD3)含有电子数为9NA
D.1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA
参考答案:C
本题解析:
正确答案:C
A、H2O2是弱电解质;B、不正确,Al3+部分水解;C、正确;D、铁只生成Fe2+,转移电子数小于3NA
本题难度:一般
4、选择题 配制100mL1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是
[? ]
A.容量瓶使用前有少量蒸馏水
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.在转移过程中有溶液撒在外面
D.定容时俯视确定凹液面与刻度线相切
参考答案:D
本题解析:
本题难度:简单
5、填空题 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:
①烧杯?②100mL量筒?③容量瓶?④药匙?⑤玻璃棒?⑥托盘天平(带砝码)
(1)配制时,没有使用的仪器和用品有______(填序号),还缺少的仪器是______.
(2)在配制的转移过程中某学生进行如图操作,请指出其中的错误:______、______
(3)如图操作会使配制的溶液浓度偏低的是______(填字母)
A、没有将洗涤液转移到容量瓶?B、转移过程中有少量溶液溅出
C、容量瓶洗净后未干燥?D、定容时俯视刻度线
(4)在容量瓶使用方法中,下列操作不正确的是______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(5)实验中还需要2mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是______.
A.1000mL,80g?B.950mL,76g?C.任意规格,72g?D.500mL,42g.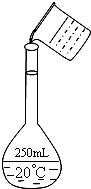
参考答案:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要的仪器为胶头滴管,用不到100mL量筒,故答案为:②;胶头滴管;
(2)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制250mL的溶液要采用250mL的容量瓶,故答案为:未用玻璃棒引流;容量瓶规格不对;
(3)A.没有将洗涤液转移到容量瓶,氢氧化钠的实际质量减小,溶液浓度偏低,故A正确;
B.转移过程中有少量溶液溅出,氢氧化钠的实际质量减小,溶液浓度偏低,故B正确;
C.最后需用蒸馏水定容,容量瓶洗净后未干燥无影响,故C错误;
D.定容时俯视刻度线,会导致溶液体积偏小,溶液浓度偏高,故D错误.
故选AB.
(4)A.容量瓶在使用前要检查是否漏水,因配制后要摇匀,故A正确;
B.容量瓶用蒸馏水洗净后,不能用待配溶液润洗,会导致溶液浓度偏大,故B错误;
C.氢氧化钠有腐蚀性,应在小烧杯中称量,故C错误;
D.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动几次,目的是使溶液充分混合,浓度均匀,故D正确;
故答案为:BC.
(5)因需2mol?L-1的NaOH溶液950mL,
则选择1000mL容量瓶,1000mL=1L,
NaOH的物质的量为1L×2mol?L-1=2mol,
NaOH的质量为2mol×40g/mol=80g,
即需要1000mL容量瓶、80gNaOH,
故选A.
本题解析:
本题难度:一般