1、选择题 下列各组物质的性质比较,正确的是( )
A.酸性:
B.氢化物稳定性:HCl>H2S>H2O
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.离子半径:Na+>Mg2+>Cl-
参考答案:A.非金属性:Cl>S>P,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,则酸性:HClO4>H2SO4>H3PO4,故A错误;
B.非金属:O>Cl>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:H2O>HCl>H2S,故B错误;
C.金属性:Na>Mg>Al,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
D.离子的核外电子层数越多,离子半径越大,Na+和Mg2+核外有2个电子层,Cl-核外有3个电子层,则离子半径最大的是Cl-,故D错误.
故选C.
本题解析:
本题难度:一般
2、填空题 下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。

(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多_______个。元素③氢化物的电子式为_______。
(3)元素④一般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断
参考答案:(1)“略”
(2)1个;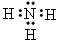
(3)-2;氟
(4)c
本题解析:
本题难度:一般
3、选择题 下列递变规律中,错误的是( )
A.Na、Mg、Al的还原性依次减弱
B.N2、O2、F2的氧化性依次增强
C.C、N、O的原子半径依次增大
D.P、S、Cl的最高化合价依次升高
参考答案:C
本题解析:
本题难度:一般
4、推断题 A、B、C、D、E、F属于短周期主族元素。A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n,M层电子数为m-n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零。
(1)B2-的离子结构示意图___________,DE2的电子式___________。
(2)A、B形成的简单离子的半径由大到小的顺序为___________(用具体符号表示)。
(3)由D、F可以构成的最简单的化合物W,取356g分子式为W·9H2O的化合物,将其释放的W完全燃烧生成液态水,可放出1780.6kJ的热量,则W燃烧的热化学方程式为___________________________。
(4)Fe(NO3)3溶液中插入过量EB2反应的离子方程式:__________________________。
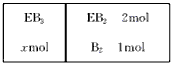
(5)如下图所示,在一定温度下,在一个容积为4L的密闭容器中,左室加入xmolEB3,右室加入2mol
EB2和1mol B2,中间是个可移动的隔板,在少量催化剂存在下分别发生反应:
左室:2EB3(g) 2EB2(g)+O2(g)
2EB2(g)+O2(g)
右室:2EB2(g)+O2(g) 2EB3(g);△H=-197kJ/mol 若将隔板固定在中央,且x=1,达平衡时右室的压强是起始时的0.7倍,则左室反应的平衡常数K=_______________。
2EB3(g);△H=-197kJ/mol 若将隔板固定在中央,且x=1,达平衡时右室的压强是起始时的0.7倍,则左室反应的平衡常数K=_______________。
参考答案:(1)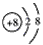 ;
;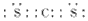
(2)O2->Na+
(3)CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H=-890.3kJ/mol
(4)Fe3++3NO3-+5SO2+4H2O==Fe2++5SO42-+3NO↑+8H+
(5)1/1620(或6.17×10-4)
本题解析:
本题难度:困难
5、选择题 根据元素周期律判断,下列元素气态氢化物最稳定的是( )
A.Cl
B.S
C.P
D.Si
参考答案:Si、P、S、Cl均位于元素周期表中的第三周期,从左向右非金属性增强,
则Cl的非金属性最强,所以其气态氢化物最稳定,
故选A.
本题解析:
本题难度:简单