1、选择题 光盘是由二氧化硅玻璃材质制成.下列有关推断正确的是
A光盘遇水腐蚀? B光盘遇火会熔化
C光盘遇碱会腐蚀? D二氧化硅是导体
参考答案:
C
本题解析:
二氧化硅不与水反应,二氧化硅是原子晶体,熔点高,且不导电,二氧化硅是酸性氧化物,能与碱反应。
本题难度:一般
2、选择题 2001年报道硼和镁形成的化合物刷新了金属化合物最高温度的记录。右示意图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子;6个硼原子位于棱柱内(未画出)。则该化合物的化学式可表示为?(?)
A.MgB
B.MgB2
C.Mg2B
D.Mg3B2
参考答案:B
本题解析:正六棱柱上的原子:顶点按照1/6计,面上按照1/2计,棱柱内按照1计。则镁原子与硼原子个数比为:(12×1/6+2×1/2)∶6=1∶2,该化合物的化学式可表示为MgB2。故选B项。
本题难度:简单
3、选择题 某混合气体中可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混合气体依次通过:①澄清石灰水(无浑浊现象);②Ba(OH)2溶液(有浑浊现象);③浓H2SO4(无现象);④灼热的氧化铜(变红);⑤无水硫酸铜(变蓝)。对该混合气体成分判断正确的是(? )
A.一定没有CO2,肯定有H2
B.一定有CO、CO2和水蒸气
C.一定有H2、CO2和HCl
D.可能有CO2、NH3和水蒸气
参考答案:C
本题解析:由②可知,混合气体中一定有CO2,结合①知,一定有HCl,故一定无NH3,由④⑤知一定有H2,而无法判定是否一定有CO和水蒸气,综合得答案为C。
本题难度:简单
4、填空题 请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷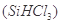 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
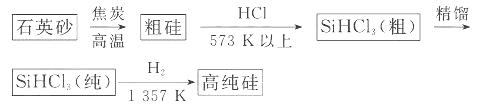
①写出由纯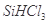 制备高纯硅的化学方程式: ____________________________________。
制备高纯硅的化学方程式: ____________________________________。
②整个制备过程必须严格控制无水无氧。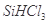 遇水剧烈反应生成
遇水剧烈反应生成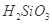 、HCl和另一种物质,配平后的化学反应方程式为___________________________;
、HCl和另一种物质,配平后的化学反应方程式为___________________________;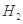 还原
还原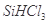 过程中若混入
过程中若混入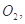 可能引起的后果是____________________________________。
可能引起的后果是____________________________________。
(2)下列有关硅材料的说法正确的是_________ (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高