1、选择题 甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加.已知:甲最外层电子数最少,丁氢化物水溶液是一种常见强酸,丙的最外层电子数是最内层电子数的两倍,下列判断正确的是( )
A.原子半径:甲<乙
B.最外层电子数:乙>丙
C.电解甲和丁形成化合物的水溶液可获得甲单质
D.丙的氧化物溶于甲的氧化物的水化物
参考答案:甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加,丙的最外层电子数是最内层电子数的两倍,若为第二周期元素,则丙为C,若为第三周期元素,则丙为Si;甲最外层电子数最少,则甲为Li或Na;丁氢化物水溶液是一种常见强酸,则为第二周期时,丁为N,其氢化物的水溶液显碱性,为F时HF为弱酸,所以甲、乙、丙、丁四种元素在第三周期,甲为Na,乙为Mg或Al,丙为Si,丁为S或Cl,
A.同周期从左向右原子半径在减小,则原子半径为甲>乙,故A错误;
B.同周期从左向右最外层电子数在增大,则最外层电子数为乙<丙,故B错误;
C.电解甲和丁形成化合物的水溶液得到金属对应的碱,电解熔融的化合物能得到单质,故C错误;
D.二氧化硅能与NaOH溶液反应,则丙的氧化物溶于甲的氧化物的水化物,故D正确;
故选D.
本题解析:
本题难度:简单
2、填空题 下列分子结构图中的

表示氢原子,

表示短周期的相邻的三种元素原子.小黑点表示没有形成共价键的最外层电子,短线表示共价键
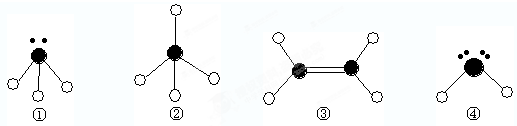
(1)以上分子中,中心原子采用sp2杂化的是______(填化学式);
(2)在③的分子中有______个σ键.在③与溴的四氯化碳溶液反应中,断裂的是③分子中的______键(填“σ”或“π”),形成的是______键(填“σ”或“π”).
(3)4种分子中,属于极性分子的是______(填序号,下同).键角由大到小的顺序是______,能结合质子(即H+)形成稳定离子的是______,形成______键(按电子对提供方式分类).
(4)已知液态①和④相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则①的电离方程式为:______.
参考答案:由结构模型可知①为NH3,②为CH4,③为C2H4,④为H2O或H2S,
(1)①为sp3杂化,②为sp3杂化,③为sp2杂化,④为sp3杂化,故答案为:C2H4;
(2)③为C2H4,含有5个δ键,C=C中有1个δ键,1个π键,π键不稳定,加成反应时易断裂,重新生成δ键,
故答案为:5;π;δ;
(3)①④结构部对称,属于极性分子,键角由大到小的顺序是③②①④,①④含有孤对电子,可形成配位键,
故答案为:①④;③②①④;①④;配位;
(4)①为NH3,可水的电离相似,则应存在2NH3?NH4++NH2-,故答案为:2NH3?NH4++NH2-.
本题解析:
本题难度:一般
3、选择题 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.第一电离能Y可能小于X
B.气态氢化物的稳定性:HmY大于HnX
C.最高价含氧酸的酸性:X对应的酸性强于Y对应的
D.X和Y形成化合物时,X显负价,Y显正价
参考答案:B
本题解析:
本题难度:简单
4、选择题 某化学课外活动小组甲同学欲制备收集A气体,乙同学欲制备收集B气体(制备方法、装置、试剂的化学式均相同).甲采用排水法收集到B气体,乙用排空气法却得到A气体.下列关于A、B两种气体的叙述不正确的是( )
A.A、B都是极性分子
B.A、B气体分子中均含有极性键
C.A为酸酐,B则不属于酸酐
D.A、B气体相对分子质量之差为16
参考答案:C
本题解析:
本题难度:简单
5、简答题 A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2.C、D的电离能数据如下(kJ?mol-1):
| I1 | I2 | I3 | I4
C
738
1451
7733
10540
D
577
1817
2745
11578
|
(1)化合价是元素的一种性质.由C、D的电离能数据判断,C通常显______价,D显______价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含______个σ键,______个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是______.
| 单键 | 双键 | 叁键
AB
键能(kJ?mol-1)
357.7
798.9
1071.9
甲
键能(kJ?mol-1)
154.8
418.4
941.7
|
 (4)E能与AB形成配合物,其中E提供______,AB提供______.
(4)E能与AB形成配合物,其中E提供______,AB提供______.
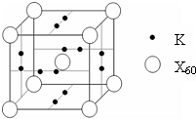
(5)如图所示晶胞中,阳离子与阴离子的个数为______.
参考答案:A、B、C、D四种短周期元素原子序数依次增大,B元素的最外层电子数是其电子层数的3倍,由于最外层电子数不超过8,1个电子层最多容纳2个电子,故B原子有2个电子层,最外层电子数为6,则B为氧元素;A元素原子的价电子排列为ns2np2,处于ⅣA族,原子序数小于氧元素,则A为碳元素;C元素的第三电离能剧增,表现+2价,处于ⅡA,原子序数大于氧元素,故C为Mg元素;D元素的第四电离能剧增,表现+3价,处于ⅢA族,则D为Al元素;E元素原子的价电子排布为3d64s2,核外电子数为26,为Fe元素,
(1)C元素的第三电离能剧增,表现+2价;D元素的第四电离能剧增,表现+3价,故答案为:+2;+3;
(2)某单质甲分子与化合物CO分子中电子总数相等,则甲分子为N2,分子中存在N≡N三键,包含1个σ键,2个π键,故答案为:1;2;
(3)据表中数据可知,断裂C≡O中的一个π键消耗的能量是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,断裂N≡N中的一个π键消耗的能量是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼,
故答案为:断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼;
(4)E为Fe,含有空轨道,CO含有孤对电子,二者形成配合物,故答案为:空轨道;孤对电子;
(5)由晶胞结构可知,晶胞中含有K+离子数目为2×6×12=6,阴离子数目为1+8×18=2,故阳离子与阴离子的个数为6:2=3:1,故答案为:3:1.
本题解析:
本题难度:简单