1、计算题 如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液Cu2+的浓度。
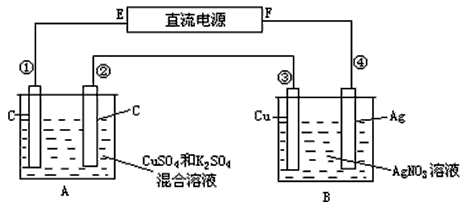
参考答案:解:在A池中发生的反应为:
阳极(②极):4OH--4e-=2H2O+O2↑
阴极(①极):2Cu2++4e-=2Cu
若Cu2+完全放电后还有:4H++4e-=2H2↑
转移电子的物质的量为:2.16÷108=0.02(mol)
由电极反应可知,每转移4mol电子,放出1molO2,所以②极上析出O2的体积为:
0.02÷4×22.4=0.112(L)<0.224(L)
说明A池收集到的气体中还有H2。
①极上放出H2为:0.224-0.112=0.112(L),即0.005mol。
①极上析出Cu和放出H2共获得0.02mol电子。
Cu2+的物质的量为:(0.02-0.005×2)/2=0.005(mol)
[Cu2+]=0.005/0.2=0.025mol/L
答:通电前A池中原混合溶液Cu2+的浓度为0.025mol/L。
本题解析:
本题难度:一般
2、选择题 在反应3BrF3+5H2O=HBrO3+9HF+Br2+O2↑,若有0.3molH2O被氧化,则被水还原的BrF3的物质的量是
A.0.15mol
B.0.2mol
C.0.3mol
D.0.4mol
参考答案:B
本题解析:
本题难度:困难
3、选择题 亚硝酸(HNO2)在反应中既可作还原剂,又可以作氧化剂,当它被还原时,其还原产物可能是
①NH3
②N2
③NO2
④HNO3
A.只有①
B.①和②
C.只有④
D.③和④
参考答案:B
本题解析:
本题难度:简单
4、选择题 已知A2On2-可与B2-反应,B2-被氧化为B单质,A2On2-被还原为A3+,若100mL0.3mol·L-1的A2On2-溶液,与150mL0.6mol·L-1的B2-溶液恰好完全反应,则n的值为
A.5
B.6
C.7
D.8
参考答案:C
本题解析:
本题难度:简单
5、选择题 根据反应:2H2S+O2=2S↓+2H2O、4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O ?Na2S+I2=2NaI+S↓,判断下列物质的氧化性强弱,正确的是:?
A.O2>I2>S
B.H2S>NaI>H2O
C.S>I2>O2
D.H2O> H2S > NaI
参考答案:A
本题解析:试题分析:在氧化还原反应中,氧化剂的氧化性强于氧化产物的,还原剂的还原性强于还原产物的。则根据反应2H2S+O2=2S↓+2H2O可知,氧化性是O2>S;根据反应4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O可知,氧化性是O2>I2;根据反应Na2S+I2=2NaI+S↓可知氧化性是I2>S,综上所述可知,选项A正确,答案选A。
考点:考查还原性强弱的判断
点评:该题是基础性试题的考查,难度不大。主要是考查学生根据氧化还原反应判断还原性强弱的了解掌握情况,有利于培养学生的逻辑推理能力。该题的关键是准确判断出还原剂和还原产物。
本题难度:简单