1、选择题 在强酸性溶液中,可大量共存且形成无色溶液的一组离子或分子是(? )?
A.Ca2+、CH3COOH、Cl?、Na+
B.Fe3+、Mg2+、SO42?、NO3?
C.NH3·H2O、Ba2+、Na+、Cl?
D.K+、Cl-、Mg2+、CO32?
参考答案:A
本题解析:注意题目中的限制条件:强酸,无色溶液;B中Fe3+黄色,C中NH3·H2O与H+反应;D中CO32?与Mg2+、H+都反应。
本题难度:一般
2、选择题 下列各组离子中,在强酸性的溶液由于发生氧化还原反应而不能大量共存的是
A.Na+、SO42-、Ba2+、Cl-
B.Mg2+、K+、CO32-、NO3-
C.Na+、SO32-、NO3-、Cl-
D.Ca2+、HCO3-、Cl-、NH4+
参考答案:C
本题解析:题目要求:发生氧化还原反应而不能大量共存,C.SO32-和NO3-(H+)发生氧化还原反应而不能共存。-
A.SO42-和Ba2+生成沉淀,属于复分解反应;-?
B.CO32-和H+反应生成气体,属于复分解反应;
D.HCO3和H+反应生成气体,属于复分解反应;
点评:考查离子共存。离子共存,即不反应,无沉淀,无气体,无弱电解质生成;
本题难度:一般
3、选择题 ?室温下,下列各组粒子在指定溶液中一定能大量共存的是
A. pH=0的溶液中:
B.加入金属镁能产生H:的溶液中: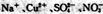
C.加人KSCN显血红色的溶液中:
D.常温下由水电离出的?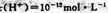 的溶液::
的溶液::
参考答案:C
本题解析:A错,pH=0的溶液为酸性溶液,其中CLO—、CH3CHO不能共存;B错,加入金属镁能产生氢气的溶液为酸性溶液,其中镁离子能与铜离子发生反应,则无氢气生成;C正确;D错,水电离出的?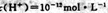 的溶液为抑制水的电离,可以是酸性溶液,可以是碱性溶液,在碱性溶液中镁离子不能共存;
的溶液为抑制水的电离,可以是酸性溶液,可以是碱性溶液,在碱性溶液中镁离子不能共存;
本题难度:一般
4、填空题 河道旁有甲、乙两厂。它们排放废水中含K+、Ag+、Fe3+、C1-、OH-、NO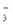 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是?、?、?。
(2)乙厂的废水中含有另外三种离子。如果加一定量?(选填“活性炭”“铁粉”),可以回收其中的?。
参考答案:(1)OH-、Cl-、K+?(2)铁粉? Ag
本题解析:
:(1)甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl--、OH-不能共存,,根据溶液电中性可知乙厂还有NO3-,
由此可知:甲厂含有K+、Cl--、OH-,乙厂含有Ag+、Fe3+、NO3-,故答案为:K+、Cl--、OH-;
(2)含有的金属离子有K+、Ag+、Fe3+,加入单质Fe,可置换出Ag,故答案为:铁粉;Ag;
本题难度:一般
5、选择题 下列有关平衡常数的说法正确的是(?)
A.已知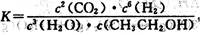 ,则对应的化学反应可以表示为:
,则对应的化学反应可以表示为:
2CO2( g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g)
B.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
C.常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大
D.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变
参考答案:B
本题解析:A 错误,平衡常数是平衡时生成物浓度幂的乘积比反应物浓度幂的乘积
B 正确,氢氟酸的电离是吸热反应,升温,平衡右移,电离平衡常数Ka将变大
C 错误,碳酸跟离子水解促进水的电离,但Kw只跟温度有关,所以Kw不变
D 错误,化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,但不可能不变。
本题难度:简单