1、计算题 (8分)有Na2SO4和Na2CO3混合溶液10.0mL,加入足量BaCl2溶液,充分反应后,经过滤、洗涤、烘干,得到白色沉淀1.45g,将沉淀与过量的盐酸反应,得到112mLCO2气体(标况)。求原混合溶液中Na2SO4和Na2CO3的物质的量浓度?
参考答案:
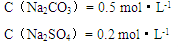
本题解析:略
本题难度:一般
2、选择题 具有相同数目氧原子的SO2和SO3,下列关系中一定正确的是
A.n(SO2): n(SO3) ="" 2:3
B.V(SO2): V(SO3) =" 3:2"
C.m(SO2): m(SO3) ="" 6:5
D.Mr(SO2) : Mr(SO3) = 5:4
参考答案:C
本题解析:略
本题难度:一般
3、选择题 同温同压下,等质量的O2和CO2相比较,下列叙述正确的是(?)
A.体积比为8:11
B.分子个数之比为11: 12
C.物质的量之比为8:11
D.原子个数之比为11: 12
参考答案:D
本题解析:在相同条件下,等质量的O2和CO2的物质的量之比是44︰32=11︰8,所以ABC都是错误的,正确的答案选D。
本题难度:一般
4、选择题 某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低。该学生得出了以下原因,其中是使溶液浓度偏低的原因的是
A.容量瓶刚用氢氧化钠溶液润洗过
B.在转移溶液时不小心洒落瓶外
C.在烧杯中溶解了氢氧化钠后,趁热将溶液到入容量瓶,并迅速配成了溶液
D.定容时,俯视刻度线
参考答案:B
本题解析:A 相当于溶质放的多,所配溶液浓度偏高
B 相当于溶质有损失,所配溶液浓度偏低
C 冷却后溶液体积会变小,趁热定容,相当于溶剂放的少,所配溶液浓度偏高
D定容时,俯视刻度线,溶剂放的少,所配溶液浓度偏高。故选B 。
本题难度:简单
5、实验题 氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式。
?
(2)实验室欲制得氯气1.12 L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36 L 氯气与4.0 mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是?
?。
参考答案:(1)MnO2+4HCl(浓) ? MnCl2+2H2O+Cl2↑(2分)
? MnCl2+2H2O+Cl2↑(2分)
(2)4.35 g(3分)
(3)① 75 mL?(3分)
② 通入氯气过快,未与氢氧化钠溶液充分反应(2分)(其他合理答案也给分)
本题解析:(2)制得氯气1.12 L,n=V/Vm=0.05mol
MnO2+4HCl(浓) ? MnCl2+2H2O+Cl2↑
? MnCl2+2H2O+Cl2↑
1? 1
X? 0.05mol
X=0.05mol?二氧化锰质量m=M×n=0.05mol×87g/mol="4.35" g
(3)?①: Cl2+2NaOH=NaCl+NaClO+H2O
由反应可知:氯气和氢氧化钠的物质的量之比为1:2. n(Cl2)=V/Vm=0.15mol
n(NaOH)=2n(Cl2)=0.3mol。V=n/C=0.3mol/(4.0 mol/L)=0.075L=75ml
②:产物的质量明显小于理论值,说明二者没有充分反应,可能是通入氯气过快?
点评:本题集合氯气的性质和制取,物质的量的简单计算,题目难度不大,但要能正确书写出化学方程式,并按照解析步骤逐步解答。
本题难度:一般