1、填空题 (10分)已知H2SO3是二元弱酸,常温下现有0.1 mol/L H2SO3溶液,请回答以下问题:
(1)若向H2SO3溶液中加入少量NaHSO3固体,此时溶液中c(H+)/ c(HSO3-)________(填“增大”“减小”或“不变”)。
(2)若向H2SO3溶液中加入等浓度的NaOH溶液,且二者的体积比为2∶3,若反应后溶液可使紫色石蕊变红色,则所得溶液中物料守恒式为0.1 mol/L=______________,所得溶液中各离子的物质的量浓度由大到小的顺序是__________________。
(3)若向H2SO3溶液中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)______2c(SO32-)(选填“>”、“<”或“=”)。
(4)若向H2SO3溶液中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中
2c(SO32-) +c(HSO3-)-c(Na+)=________mol/L。
参考答案:(1)减小 (2)c(Na+)+c(SO32-)+c(HSO3-)+c(H2SO3) c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-)
(3) > ( 4 ) 10-6-10-8
本题解析:(1)H2SO3溶液存在电离平衡,H2SO3 H++ HSO3-,加入NaHSO3固体使得c(HSO3-)增大,所以c(H+)/ c(HSO3-)减小。(2)加入NaOH溶液,体积比为2∶3,H2SO3溶液过量,溶液的主要溶质为NaHSO3,Na2SO3,物料守恒为:c(Na+)+c(SO32-)+c(HSO3-)+c(H2SO3) =0.1 mol/L,HSO3的电离程度大于水解程度,故溶液显酸性,浓度关系为c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-)。(3)根据电荷守恒 c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性则c(H+)= c(OH-),所以c(Na+)+ =2c(SO32-)+c(HSO3-),故c(Na+) >2c(SO32-)。( 4 )根据电荷守恒c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-), pH=6,所以c(H+)=10-6 mol/L, c(OH-)=10-8 mol/L得2c(SO32-) +c(HSO3-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8
H++ HSO3-,加入NaHSO3固体使得c(HSO3-)增大,所以c(H+)/ c(HSO3-)减小。(2)加入NaOH溶液,体积比为2∶3,H2SO3溶液过量,溶液的主要溶质为NaHSO3,Na2SO3,物料守恒为:c(Na+)+c(SO32-)+c(HSO3-)+c(H2SO3) =0.1 mol/L,HSO3的电离程度大于水解程度,故溶液显酸性,浓度关系为c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-)。(3)根据电荷守恒 c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性则c(H+)= c(OH-),所以c(Na+)+ =2c(SO32-)+c(HSO3-),故c(Na+) >2c(SO32-)。( 4 )根据电荷守恒c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-), pH=6,所以c(H+)=10-6 mol/L, c(OH-)=10-8 mol/L得2c(SO32-) +c(HSO3-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8
考点:水解平衡的离子浓度小大小比较。
本题难度:困难
2、选择题 已知某温度下,0.1mol·L-1 NaHA的强电解质溶液中,c(H+) < c(OH-),
则下列关系一定正确的是
A.c(Na+) = c(HA-) + 2c(A2-) + c(OH-)
B.c(H+)·c(OH-) = 10-14
C.c(H2A) + c(HA-) + c(A2-) =" 0.1" mol·L-1
D. c(A2-) + c(OH-) = c(H+) + c(H2A)
参考答案:CD
本题解析:由题意c(H+) < c(OH-),则NaHA溶液中以HA—离子水解为主,电离很弱,溶液显碱性,所以;
A错,正确为:c(H+)+c(Na+) = c(HA-) + 2c(A2-) + c(OH-);B错,温度不一定是在25℃;C正确,物料守恒;D正确,质子守恒;
本题难度:一般
3、简答题 (12分) (1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质
| H2(g)
| Br2(g)
| HBr(g)
|
1 mol分子中化学键断裂时需要吸收的能量/kJ
| 436
| 200
| 369
|
H2(g)+Br2(l)=2HBr(g) ΔH= 。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示: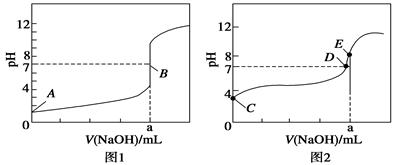
①根据图1和图2判断,滴定HBr溶液的曲线是 (填“图1”或“图2”);
②a= mL;
③c(Na+)=c(CH3COO-)的点是 点;
④E点对应溶液中离子浓度由大到小的顺序为 。
参考答案:(1)-72 kJ·mol-1 (2)CH3CH(OH)COO- + H2O CH3CH(OH)COOH +OH-
CH3CH(OH)COOH +OH-
(3)① 图1 ②20.00 ③ D ④c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
本题解析:(1)化学反应中化学键断裂吸收能量,形成化学键放出能量,反应热等于反应物的总键能减生成物的总键能。由化学键的键能可知H2(g)+Br2(g)=2HBr(g)△H=(436kJ/mol+200kJ/mol)-2×(369kJ/mol)=-102kJ/mol,因蒸发1mol Br2(l)需要吸收的能量为30kJ,则H2(g)+Br2(l)=2HBr(g)△H为=(-102kJ/mol)+(+30kJ/mol)=-72 kJ/mol。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,由于氢溴酸是强酸,因此有一种酸的pH=4,则该酸一定是氢溴酸,这说明乳酸是弱酸,所以乳酸钠溶液中的水解离子方程式为CH3CH(OH)COO- + H2O CH3CH(OH)COOH +OH-。
CH3CH(OH)COOH +OH-。
(3)①如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为氢溴酸滴定曲线,。
②滴定20.00mL 0.1000mol/L 氢溴酸溶液,NaOH和HBr恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,滴定终点时n(HBr)=n(NaOH),则a=20.00mL。
③c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,故答案为:D。
④根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),盐类水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
考点:考查反应热计算、水解方程式、酸碱中和反应滴定曲线的有关判断
本题难度:困难
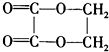
4、选择题 以乙醇为原料,用6种类型的反应:①氧化、②消去、③加成、④酯化、⑤水解、⑥加聚,来合成环乙二酸乙二酯(
)的正确顺序是( ? )
A.①⑤②③④
B.①②③④⑤
C.②③⑤①④
D.②③⑤①⑥
参考答案:C
本题解析:
本题难度:一般
5、选择题 丙烯醇(CH2═CHCH2OH)可发生的化学反应有( )
①取代反应 ②加成反应 ③加聚反应 ④氧化反应.
A.①③④
B.②③
C.①②③④
D.②③④
参考答案:C
本题解析:
本题难度:一般