1、简答题 现有下列5种有机物:①甲苯、②乙醛、③乙酸乙酯、④苯酚、⑤乙烯.
(1)上述物质中能发生水解反应的是(填序号,下同)______;能发生银镜反应的是______;属于聚合物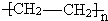 的单体是______.
的单体是______.
(2)上述物质有1种能与浓溴水反应产生白色沉淀,写出反应的化学方程式______.
参考答案:(1)③乙酸乙酯含有酯基,能发生水解反应;②乙醛含有醛基,能发生银镜反应;聚合物 的单体即为将两个半键闭合即可,即CH2═CH2;
的单体即为将两个半键闭合即可,即CH2═CH2;
故答案为:③;②;⑤;
(2)苯酚能与浓溴水反应产生三溴苯酚白色沉淀,方程式为: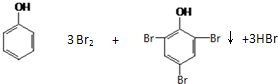 ,故答案为:
,故答案为: ;
;
本题解析:
本题难度:简单
2、选择题 下列解释实验事实的方程式不准确的是
[? ]
A.?0.1?mol/L?CH3COOH溶液的pH>1:CH3COOH? CH3COO-+H+
CH3COO-+H+
B.?“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)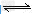 ?N2O4(g);△H<0 ?
?N2O4(g);△H<0 ?
C.?铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-=3Fe2+ +2NO↑+4H2O ?
D.?向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+H2O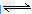 ?HCO3-+OH-
?HCO3-+OH-
参考答案:C
本题解析:
本题难度:一般
3、选择题 常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L
参考答案:C
本题解析:试题分析:等体积混合后,溶液的溶质应该为NaY,浓度应该为0.15mol/L,但是最后溶液显碱性,说明发生了水解。A选项错误,由pH值计算得到氢离子的浓度为1×10-9 mol/L,则氢氧根离子的浓度应该为1×10-5 mol/L。B选项由于NaY发生水解,则c(Y-)<c(Na+),错误。C选项正确,此等式为质子守恒。D选项最后溶液体积为原来的两倍,钠离子的浓度应该是原来的一半,则为0.15mol/L。
考点:盐类的水解
点评:本题涉及到了一个难点知识盐类的水解,学生在做题时经常会遇到的问题有离子浓度大小的判断,盐类水解中的三个守恒关系的判定,这些需要学生多加练习,熟能生巧。
本题难度:一般
4、填空题 已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
a.大于7 b.等于7 c.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol/L,B溶液中水电离出的氢离子浓度为 mol/L。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
参考答案:(1)b
(2)10-10 10-12
(3)M++H2O MOH+H+
MOH+H+
本题解析:(1)pH=3的盐酸中的c(H+)与pH=11的氢氧化钡溶液中的c(OH-)相等,都等于1×10-3 mol·L-1,二者等体积混合后恰好完全反应,溶液呈中性。
(2)醋酸和氢氧化钠均抑制水的电离。
(3)a+b=14的意义为酸中c(H+)与碱中c(OH-)相等,二者混合后溶液呈碱性,说明碱为弱碱,反应中碱过量。故弱碱阳离子M+水解。
本题难度:一般
5、选择题 常温下,下列物质的水溶液,其pH值大于7的是
A.KNO3
B.NaHSO4
C.NH4Br
D.NaF