1、选择题 下列有关反应颜色变化的叙述中,正确的是( )
①新制氯水久置后→浅黄绿色消失
②淀粉溶液遇单质碘→蓝色
③蔗糖中加入浓硫酸搅拌→白色?
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
A.①②③④
B.②③④⑤
C.①②④⑤
D.全部
参考答案:①氯水久置后,HClO分解,最终为盐酸溶液,则浅黄绿色消失,故①正确;
②淀粉遇碘单质变蓝,为淀粉的特性,故②正确;
③浓硫酸具有脱水性,则蔗糖中加入浓硫酸搅拌最终为黑色,故③错误;
④二氧化硫具有漂白性,则SO2通入品红溶液中使红色褪去,故④正确;
⑤氨气的水溶液显碱性,则氨气通入酚酞溶液中,溶液变为红色,故⑤正确;
故选C.
本题解析:
本题难度:简单
2、选择题 将新制氯水分别滴加到下列溶液中至过量,对所观察到的现象描述合理的一组是( )
| ? | AgNO3溶液 | 加有酚酞的NaOH溶液 | 石蕊溶液 | 品红溶液 | Na2CO3溶液
A
产生沉淀
无明显变化
变红
溶液褪色
有气泡
B
无明显变化
溶液褪色
变红
无明显变化
产生沉淀
C
产生沉淀
溶液褪色
先变红后褪色
溶液褪色
有气泡
D
产生沉淀
无明显变化
先变红后褪色
无明显变化
产生沉淀
|
A.A
B.B
C.C
D.D
参考答案:A.氯水呈酸性,并具有氧化性和漂白性,加入到滴有酚酞的NaOH溶液,溶液颜色褪色,故A错误;
B.氯水中含有Cl-离子,滴入到硝酸银溶液中有AgCl沉淀生成,含有HClO,可使品红褪色,含有H+,与碳酸钠反应生成气体,故B错误;
C.氯水中含有Cl-离子,滴入到硝酸银溶液中有AgCl沉淀生成,含有HClO,加入到滴有酚酞的NaOH溶液,溶液颜色褪色,可使品红褪色,含有H+,与碳酸钠反应生成气体,可使石蕊先变红后褪色,故C正确;
D.氯水中含有HClO,加入到滴有酚酞的NaOH溶液,溶液颜色褪色,可使品红褪色,含有H+,与碳酸钠反应生成气体,可使石蕊先变红后褪色,故D错误.
故选C.
本题解析:
本题难度:一般
3、选择题 下列离子方程式书写正确的是(?)
A.次氯酸钙溶液中通入过量的CO2Ca2++2ClO-+H2O+CO2====CaCO3↓+2HClO
B.氢氧化钠溶液吸收氯气 2OH-+Cl2====Cl-+ClO-+H2O
C.盐酸与硝酸银溶液反应 HCl+Ag+====AgCl↓+H+
D.氯气通入水中 Cl2+H2O====2H++Cl-+ClO-
参考答案:B
本题解析:A项中过量CO2应生成Ca(HCO3)2,C项中HCl应是离子,D项中HClO应是分子。
本题难度:一般
4、填空题 氯气是一种非常重要的化工原料,含氯消毒剂在生产生活中有着广泛的用途。
(1)用氯气可制取“84消毒液”(有效成分为NaClO)。
①该制备反应的离子方程式为?。
②下列措施能增强“84消毒液”杀菌能力的是?。
A.加入适量醋酸
B.加入适量亚硫酸
C.加入少量NaOH粉末
③“84消毒液”不能对钢铁(含Fe、C)制品进行消毒,原因是?。
(2)二氧化氯(ClO2)是一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前,工业上开发出用电解法制取ClO2的新工艺,生产原理如图所示。
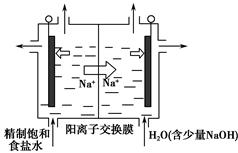
上述示意图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:?。
参考答案:(1)①Cl2+2OH-=Cl-+ClO-+H2O
②A
③“84消毒液”显碱性,钢铁在碱性条件下会发生电化学腐蚀
(2)Cl--5e-+2H2O=ClO2↑+4H+
本题解析:(1)①氯气与NaOH溶液反应可制备“84消毒液”。②加入适量醋酸,可促使ClO-转化为HClO,增强“84消毒液”的杀菌能力;加入适量亚硫酸,H2SO3会与ClO-发生氧化还原反应,不正确。③钢铁在碱性条件下能发生吸氧腐蚀,不能用“84消毒液”对钢铁制品进行消毒。(2)①电解饱和食盐水时,阳极Cl-发生氧化反应生成ClO2,根据元素守恒,可知水参与了反应,产物中应有H+。
本题难度:一般
5、实验题 某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回稳下列问题。
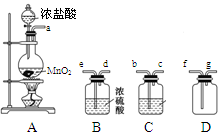
(1)装置A中发生反应的离子方程式为_______________________________。
(2)按照气流方向各仪器接口的连接顺序为a→___________________→g。
(3)装置B中浓硫酸的作用是____________________________________________________________,装置C的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
?
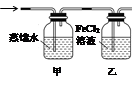
(5)装制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是_______;如何证明乙装置中FeCl2溶液与Cl2发生了反应?(只回答需要的试剂和现象)___________________________。
参考答案:(1)MnO2+4H++2Cl- Mn2++Cl2+2H2O(2分)?(2)bcedf(2分)
Mn2++Cl2+2H2O(2分)?(2)bcedf(2分)
(3)吸收水蒸气,干燥氯气(1分)?饱和食盐水(1分)?(4) (2分)
(2分)
(5)Cl2、HClO、ClO-(2分)? KSCN溶液(1分)?溶液变成红色(1分)
本题解析:(1)根据装置特点以及试剂可知,装置A是用来准备氯气的,所以A中发生反应的离子方程式为MnO2+4H++2Cl- Mn2++Cl2+2H2O。
Mn2++Cl2+2H2O。
(2)由于盐酸易挥发,所以生成的氯气中含有氯化氢以及水蒸气,因此在收集氯气之前需要首先除去氯化氢和水蒸气。首先除去的是氯化氢,所用试剂是饱和食盐水,然后在通过盛有浓硫酸的洗气瓶除去水蒸气。氯气的密度大于空气的,应该用向上排空气法收集,所以按照气流方向各仪器接口的连接顺序为a→b→c→e→d→f→g。
(3)根据以上分析可知,装置B中浓硫酸的作用是吸收水蒸气,干燥氯气;由于氯化氢极易溶于水,而氯气你溶于水,所以要除去氯气中的氯化氢气体最好选用饱和食盐水。
(4)氯气有毒,属于大气污染物,需要尾气处理。氯气能被氢氧化钠溶液吸收,所以可以用氢氧化钠溶液吸收,装置图为 。
。
(5)甲装置中盛有蒸馏水,氯气溶于水部分氯气与水反应生成盐酸和次氯酸,次氯酸是弱酸电离出氢离子和ClO-,所以甲装置溶液中具有氧化性的含氯粒子是Cl2、HClO、ClO-;氯气具有强氧化性,乙装置中盛有氯化亚铁溶液,能和氯气反应生成氯化铁。铁离子能和KSCN溶液反应而使溶液显红色,据此可以检验乙装置中FeCl2溶液与Cl2发生了反应。
本题难度:一般