1、实验题 下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
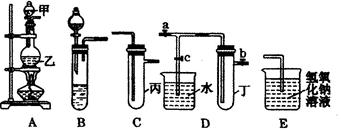
(1)将A、C、E相连后,以浓盐酸和?(填写名称)为原料制取Cl2,仪器乙的名称是?。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
实验序号
| 实验操作
| 现象
| 结论
|
Ⅰ
| 将所得氯水滴入品红溶液
| 品红溶液褪色
| 氯气与水反应的产物有漂白性
|
Ⅱ
| 向所得氯水中加入碳酸氢钠粉末
| 有无色气泡产生
| 氯气与水反应至少产生一种酸性强于碳酸的物质
|
实验Ⅰ获得结论是否合理??(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):?。
实验Ⅱ获得结论是否合理??(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):?。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是?。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先?,再?以使烧杯中的水进入试管丁,观察现象。
参考答案:(1)(4分)二氧化锰?(圆底)烧瓶
(2)(4分)不合理;没有事先证明干燥的氯气无漂白性。不合理;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠反应产生气泡。(3)(2分)产生淡黄色沉淀
(4)(2分)关闭a、b,打开c;双手紧握(或微热)试管丁,使NO2逸出与水接触(或其它合理的答案)
本题解析:(1)实验室制取氯气的试剂是浓盐酸和二氧化锰。根据仪器的结构特点可判断仪器乙是圆底烧瓶。
(2)由于没有事先证明干燥的氯气无漂白性,所以直接利用溶液褪色不能说明氯气与水反应的生成物有漂白性,因此结论不合理;由于浓盐酸易挥发,因此制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠反应产生气泡,所以结论是不合理的。
(3)由于氯气具有强氧化性,能把硫离子氧化生成单质硫,所以C中预期出现的现象是溶液变浑浊,产生淡黄色沉淀。
(4)要用D装置探究NO2与水的反应,则应该首先关闭a、b,打开c;然后用双手紧握(或微热)试管丁,使NO2逸出与水接触即可。
本题难度:一般
2、选择题 下列关于氯水的叙述中,正确的是
A.新制的氯水盛放在棕色瓶中,放置于阴凉处
B.新制的氯水中含有氯气分子,氯分子可以杀菌、消毒
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后酸性减弱
参考答案:A
本题解析:略
本题难度:一般
3、选择题 为防止储存 氯气的钢瓶被腐蚀,钢瓶在装Cl2之前必须
氯气的钢瓶被腐蚀,钢瓶在装Cl2之前必须
A.清洗干净
B.冲入惰性气体
C.除去铁锈
D.彻底干燥
参考答案:D
本题解析:略
本题难度:一般
4、选择题 在相同条件下,下列说法错误的是
A.氯气用向上排空气法收集
B.NO可用排空气法进行收集
C.碳酸的酸性比硅酸强
D.SO2的大量排放会引起酸雨
参考答案:B
本题解析:B项:一氧化氮(NO)是一种无色气体,难溶于水,密度比空气略大,通常情况下极易与氧气反应,生成红棕色的二氧化氮,故不能用排空气法收集。故选B。
点评:本题考查了NO的性质,解答本题还需要学生应该掌握根据气体的密度和溶解性来选择收集气体的方法。
本题难度:一般
5、选择题 下列物质都能与氯气反应,点燃时产生苍白色火焰的是( )
A.铜
B.铁
C.氢气
D.钠
参考答案:A、铜与氯气反应发出棕黄色烟生成固体氯化铜,故A不符合;
B、铁在氯气中反应时发出红褐色的烟,生成固体氯化铁,故B不符合;
C、氢气和氯气反应发出苍白色的火焰,生成氯化氢,瓶口有白雾形成,故C符合;
D、钠在氯气中燃烧发出白色烟生成固体氯化钠,故D不符合;
故选C.
本题解析:
本题难度:简单