1、计算题 (8分)试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为?。
(2)把1 molNa和1mol Mg分别投入到两杯体积3L浓度1mol/L的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为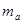 ?
? (填“”<、“>”、或“=”)。
(填“”<、“>”、或“=”)。
(3)下图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
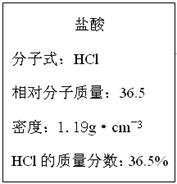
①该浓盐酸中HCl的物质的量浓度为?mol/L。
②标准状况下,1.00L水(密度:1.00g·cm-3)吸收?L的HCl可制得上述浓盐酸。
参考答案:(1)80g/mol(2分)?(2)= (2分)?(3)① 11.9(2分)?②353(2分)
本题解析:(1)根据质量守恒定律可知,生成物C的质量是24g+40g-32g=32g,所以C的摩尔质量是32g÷0.4mol=80g/mol。
(2)1mol钠生成0.5mol氢气,溶液质量增加23g-1g-22g;镁再盐酸的反应中是不足的,生成氢气是1mol,所以溶液增加的质量是24g-2g=22g,所以溶液的质量是相等的。
(3)①根据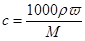 可知,该浓盐酸的物质的量浓度是
可知,该浓盐酸的物质的量浓度是
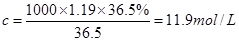 。
。
②设氨气的物质的量是x,则溶液的质量是1000g+17x,则溶液的体积是(1000g+17x)ml,所以溶液的浓度是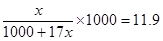 ,解得x=15.76mol,标准状况下的体积是15.76mol×22.4L/mol=353L。
,解得x=15.76mol,标准状况下的体积是15.76mol×22.4L/mol=353L。
本题难度:一般
2、填空题 (12分)(1)SO2的摩尔质量为?,1molSO2中含有氧原子的个数为?,标况下5.6LSO2的质量为?。
(2)用20g烧碱配制成500mL溶液,其物质的量浓度为?mol/L;从中取出1mL,其物质的量浓度为?mol/L;若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为?mol/L。
参考答案:(12分)(1)? 64g/ mol?,? 2NA?,? 16g?。
(2)? 1 ? mol/L;?1? mol/L;?0.01? mol/L。
本题解析:略
本题难度:一般
3、填空题 H2O2是重要的化工原料。
(1)H2O2中O元素的化合价为______。
(2)①向酸性KMnO4溶液中滴加H2O2溶液,溶液褪色,体现了H2O2的还原性,其中氧化过程是:H2O2→______(填化学式)。
②向H2SO4酸化的FeSO4溶液中滴加H2O2溶液,溶液变成黄色,体现了H2O2的氧化性,反应的离子方程式是_________。
(3)H2O2不稳定易分解。实验室需要448 mL O2(标准状况),则理论上最少需要用30%的H2O2溶液(密度为1.10 g/mL)_______mL。(计算结果保留一位小数)
参考答案: (1)-1 (2)① O2 ② 2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O (3)4.1
本题解析:(1)H2O2中H是+1价,根据化合价的代数和为零,O为-1价;(2)溶液变成黄色,说明生成了Fe3+,H2O2体现氧化性,H2O2转变成H2O,因此离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)2H2O2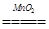 2H2O+O2↑,设最少需要H2O2vmL根据题意得出:
2H2O+O2↑,设最少需要H2O2vmL根据题意得出: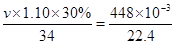 ×2解得v=4.1。
×2解得v=4.1。
考点:考查H2O2的性质。
本题难度:一般
4、选择题 用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.1∶2∶3
B.3∶2∶2
C.3∶1∶1
D.1∶3∶3