1、选择题 在密闭容器中有可逆反应:nA(g)+mB(g)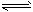 pC(g) ΔH>0处于平衡状态(已知n+m>p),则下列说法正确的是
pC(g) ΔH>0处于平衡状态(已知n+m>p),则下列说法正确的是
[? ]
①升温,c(B)/c(C)的比值变小
②降温时体系内混合气体的平均相对分子质量变小
③加入B,A的转化率增大
④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定降低
⑥若A的反应速率为υA,则B的反应速率为υAn/m
A.①②③⑤
B.①②③④
C.①②⑤⑥
D.③④⑤⑥
参考答案:B
本题解析:
本题难度:一般
2、选择题 高温下,反应2HBr(g)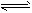 H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是
H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是
[? ]
A、减小压强
B、缩小体积
C、降低温度
D、增大氢气的浓度
参考答案:B
本题解析:
本题难度:一般
3、填空题 已知,常温下1体积水能溶解2体积氯气,并且氯水中有如下平衡:Cl2 + H2O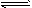 HCl + HClO
HCl + HClO
(1)常温下,在一个体积为100mL的透明玻璃针筒里吸入80mL氯气后,再吸进10mL水,振荡后静置。写出针筒中观察到的现象是_____________________。
(2)将上述针筒长时间放置,又能看到何种变化__________;试用平衡观点加以解释__________。
参考答案:(1)气体体积缩小,溶液呈浅黄绿色
(2)气体体积继续减小(至约40 mL),气体和溶液的颜色均逐渐变浅(直至无色);氯水中存在平衡
Cl2 + H2O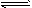 HCl + HClO,由于2HClO == 2HCl + O2↑,HClO不断分解,使上述平衡右移,最终Cl2耗尽全部转化为O2,由总关系式为:2Cl2~O2
HCl + HClO,由于2HClO == 2HCl + O2↑,HClO不断分解,使上述平衡右移,最终Cl2耗尽全部转化为O2,由总关系式为:2Cl2~O2
本题解析:
本题难度:一般
4、选择题 在一密闭容器中,反应 aA(g)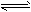 bB(g)+cC(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
bB(g)+cC(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
[? ]
A.平衡向正反应方向移动了
B.平衡向逆反应方向移动了
C.物质B的质量分数减小了
D.a>b+c
参考答案:A
本题解析:
本题难度:一般
5、简答题 下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫.

请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的化学方程式______;
(2)上图中的乙、丙分别相当于工业上制取硫酸设备中的______、______;
(3)丁中的现象为______;
(4)下图是压强对SO2平衡转化率的影响:
| 转化率%? 压强/MPa? 温度/℃ | 0.1 | 0.5 | 1 | 10
400
99.2
99.6
99.7
99.9
500
93.5
96.9
97.8
99.3
600
73.7
85.8
89.5
96.4
|
对SO2转化为SO3的反应,增大压强可使转化率______,工业生产中通常采用常压操作的原因是______.
参考答案:(1)工业接触法制硫酸三步骤:第一步:SO2的制取,第二步:SO3的制取,第三步:硫酸的生成;第一步是黄铁矿的燃烧,化学方程式为4FeS2+11O2?高温?.?2Fe2O3+8SO2,
故答案为:4FeS2+11O2?高温?.?2Fe2O3+8SO2;
(2)装置乙是把生成的二氧化硫催化氧化,相当于工业上制取硫酸设备中的接触室,装置丙相当于工业上制取硫酸设备中的吸收塔.故答案为:接触室;吸收塔;
(3)工业生成中吸收三氧化硫用98.3%的浓硫酸,用水吸收容易形成酸雾影响吸收效果;故答案为:有酸雾;
(4)工业上利用2SO2(g)+O2(g)═2SO3(g),△H=-98.3kJ?mol-1反应制备SO3,该反应为可逆反应,正方向为体积减少的放热反应,从化学平衡移动条件分析应该采用低温高压有利于生成三氧化硫;增大压强可以使二氧化硫的转化率增大;而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;同时反应中使用催化剂,为了使催化剂的催化活性最强,根据表格中提供的数据应该采用400℃~500℃;故答案为:增大;常压下SO2的转化率已很大.
本题解析:
本题难度:一般