1、简答题 老师为同学们提供了4包无标签的白色固体,它们分别是NH4Cl、NH4NO3、(NH4)2CO3和(NH4)2SO4 4种物质.老师要求同学们在实验室自行设计实验实验方案,完成鉴别上述4种白色固体的实验任务,并希望在实验后同学们进行交流、评价,提出进一步改进实验方案的建议.
(1)甲同学为鉴别4种物质,设计完成了如下实验,并填写了实验报告的部分内容.请你帮助完善下面的实验报告.
| 实验步骤 | 实验现象 | 实验现象的解释及结论
①各取少量样品于A、B、C、D 4支试管中,加入足量NaOH浓溶液,加热.
4支试管中均产生能使湿润的红色石蕊试纸变蓝的气体.
4支试管中的样品都含有______离子.
②向4支试管中分别滴加BaCl2溶液.
试管A、B中产生白色沉淀,C、D中无明显现象.
产生白色沉淀的离子方程式是______,
______.
③继续向试管A、B中分别加入足量盐酸.
试管A中沉淀溶解且产生无色气体;B中无明显变化.
试管A中原样品为______,
试管B中原样品为______.
④继续向试管C、D中分别加入足量硝酸酸化,再分别滴加AgNO3溶液.
试管C、D中均有白色沉淀产生.
无法鉴别试管C、D中的样品.
|
(2)乙同学改进了甲的实验方案,将上述实验步骤②中的BaCl2溶液,更换为______溶液,在步骤④中观察到试管C中有白色沉淀产生,试管D中无明显现象,即可鉴别出4支试管中的原样品.
(3)为进一步确认试管D中的原样品含有阴离子,两位同学补充了一个实验;再取少量试管D中的原样品,配成溶液,先滴加少量浓硫酸,然后将一束细铜丝伸入溶液中,观察到______的现象,确认了试管D中的原样品含有的阴离子,该反应的离子方程式是______.
参考答案:(1)①各取少量样品于A、B、C、D 4支试管中,加入足量NaOH浓溶液,加热,4支试管中均产生能使湿润的红色石蕊试纸变蓝的气体,应生成氨气,说明含有NH4+,
故答案为:NH4+;
?②向4支试管中分别滴加BaCl2溶液,试管A、B中产生白色沉淀,C、D中无明显现象,说明A、B为(NH4)2CO3和(NH4)2SO4中的一种,发生反应的离子方程式分别为Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓,
故答案为:Ba2++CO32-=BaCO3↓;Ba2++SO42-=BaSO4↓;?
③继续向试管A、B中分别加入足量盐酸,试管A中沉淀溶解且产生无色气体;B中无明显变化,说明A为(NH4)2CO3,B为(NH4)2SO4,故答案为:(NH4)2CO3;(NH4)2SO4 ;
(2)乙同学改进了甲的实验方案,不能引入氯离子,将上述实验步骤②中的BaCl2溶液,更换为Ba(OH)2或Ba(NO3)2,在步骤④中观察到试管C中有白色沉淀产生,试管D中无明显现象,可说明C为NH4Cl,D为NH4NO3,
故答案为:Ba(OH)2或Ba(NO3)2;
(3)检验硝酸根离子,可根据硝酸根在酸性条件下具有氧化性,可与铜反应进行检验,可观察到铜丝溶解,溶液变蓝,产生红棕色气体(或无色气体逐渐变为红棕色),
反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:铜丝溶解,溶液变蓝,产生红棕色气体(或无色气体逐渐变为红棕色);
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
本题解析:
本题难度:一般
2、实验题 为证明化学反应有一定的限度,进行如下探究活动:
I.取5 mL 0.1 mol/L的KI溶液,滴加5~6滴稀FeCl3溶液;
Ⅱ.继续加入2 mL CCl4溶液,振荡;
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为_______________ 探究活动Ⅱ的实验现象为________________
(2)探究活动Ⅲ的目的是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+; 猜想二:生成的Fe(SCN)3溶液浓度极小,无法用肉眼观察其颜色。为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中的大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN高。 结合新信息,现设计以下实验方案验证猜想:
①请完成下表:

②写出实验操作“方案一”中反应的离子方程式:_______________。
Ⅳ.为了测定探究活动I中的稀FeCl3溶液的浓度,现进行以下操作:
(3)移取25.00 mL稀FeCl3溶液至锥形瓶中,加入__________作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点时的现象是____________________。
(4)重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则稀FeCl3溶液中溶质的物质的量浓度为_______
mol/L。
参考答案:(1)液体呈棕褐色;溶液分层,下层四氯化碳层呈紫色 (2)①  ②4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓
②4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓
(3)KSCN溶液;当滴加最后一滴KI标准溶液时,红色褪去且半分钟内不恢复
(4)0.04cV
本题解析:
本题难度:一般
3、实验题 某研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质和用途,进行了如图所示实验:
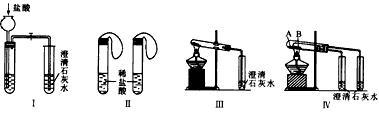
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是____ ,实验现象是___________________。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号)_________。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是_____________。
(3)若测定Na2CO3固体中混有的少量NaHCO3。的质量分数,Ⅲ能否达到实验目的?若能,请说明其计算所需的数据___________;若不能,请简要说明理由________。
参考答案:(1) NaHCO3;左边试管中的石灰水变浑浊
(2)Ⅱ、Ⅲ、Ⅳ;Ⅱ
(3)能;固体样品的质量和沉淀总质量(或反应前后固体的质量)
本题解析:
本题难度:一般
4、选择题 能证明SO2具有漂白性的是(?)
A.酸性高锰酸钾溶液中通入SO2气体后,紫色消失
B.滴有酚酞的氢氧化钠溶液中通入SO2后,红色消失
C.品红溶液通入SO2后,红色消失
D.溴水中通入SO2后,橙色消失
参考答案:C
本题解析:A、D是SO2的还原性,B是SO2溶于水生成亚硫酸,显酸性。所以正确的答案选C。
本题难度:简单
5、实验题 2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液。某学校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究。
甲同学:
为制备消毒液,探究并制作了一种家用环保型消毒液(NaClO溶液)发生器,设计了如图所示的装置,用石墨作电极电解饱和氯化钠溶液。请完成下列问题:
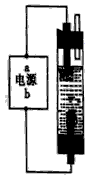
(1)若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a电极名称为__________ 极(填“正”、“负”、“阴”或“阳”),与其相连的电极的电极反应式为_____________ ;
(2)电解饱和食盐水是氯碱工业的基础反应,其化学方程式为___________ ;装置中反应生成NaClO的离子方程式为:___________ 。若在所得的NaClO溶液中逐滴加入FeCl2溶液,将看到有红褐色沉淀生成,反应的离子方程式为_______________ 。
乙同学:
从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:

请完成以下实验探究过程:
I.阅读材料,根据学过的知识判断问题
(3)室温条件下,该消毒液(NaClO)溶液的pH_____7(填“>、<或=”),原因是(用离子方程式表示)__________________。
(4)该消毒液还具有的化学性质是_________(填序号)。
A.强氧化性
B.强还原性
C.不稳定性
D.漂白性
E.弱酸性
(5)从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)_____________ 。
II.确定要研究的问题: 该消毒液对碳钢制品的腐蚀原理。
III.设计方案,实施探究
(6)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间。预期的实验现象是_________________________________。
(7)为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,丁同学设计了如下图实验装置,写出碳(C)极上发生的电极反应式:___________ 。
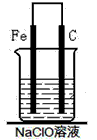
参考答案:甲:
(1)负;2H++2e-==H2↑
(2)2NaCl+2H2O==H2↑+Cl2↑+2NaOH ;?
Cl2+2OH-==Cl-+ClO-+H2O ;
ClO-+2Fe2++4OH-+H2O=2Fe(OH)3↓+Cl-
乙:(3)>; ClO-+H2O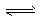 HClO+OH-?
HClO+OH-?
(4)A、D
(5)2NaClO+CO2+H2O==Na2CO3+2HClO ;
2HClO 2HCl+O2↑
2HCl+O2↑
(6)钢钉表面有红褐色物质生成
(7)ClO-+H2O+2e-==Cl-+2OH-
本题解析:
本题难度:困难