1、填空题 (8分)有关短周期元素A、B、C、D、E、F的信息如下:
元素
| 有关信息
|
A
| 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐
|
B
| 最外层电子数是次外层电子数的2倍
|
C
| M层上有3个电子
|
D
| 短周期原子半径最大的主族元素
|
E
| 其单质是淡黄色固体
|
F
| 最高正价与最低负价代数和为6
|
请回答下列问题:
(1)写出基态A原子外围电子的电子排布图 。气态氢化物乙中A原子的杂化类型是 。
(2)E、F两元素的电负性大小比较:E F(选填>、<或=)
(3)下列说法正确的是________(填序号)。
①实验室可用下图所示装置制取B的最高价氧化物。

②用C单质做成的槽车,都可用来运输甲的浓溶液。
③C形成的单质熔点低于D形成的单质的熔点。
④E的氢化物稳定性强于F的氢化物稳定性。
(4)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓 溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是________。
A.漂白剂 B.氧化剂 C.还原剂
参考答案:(8分)(除(1)题每空1分,其余每空2分)
(1)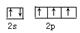 。SP3
。SP3
(2)< (
(3)①②
(4)C
本题解析:元素的最高价氧化物的水化物与气态氢化物反应的元素是N元素,硝酸与氨气反应生成硝酸铵,所以A是N元素;最外层电子数是次外层电子数的2倍的元素的次外层不可能是8个电子,所以只能是2个电子,则该元素有2层电子,分别是2、4,所以B是C元素;C元素的M层上有3个电子,则C是Al元素;短周期原子半径最大的主族元素是Na元素,在前三周期中Na的原子半径最大,所以D是Na元素;单质是淡黄色固体的元素是S,硫单质是淡黄色固体,所以E是S元素;最高正价与最低负价代数和为6的最低价位-1,最高价为+7,所以F是Cl元素。
(1)N原子的外围电子是2s22p3,电子排布图为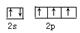 ;NH3分子中N原子的价层电子对数是3+1/2(5-3)=4,所以N原子的杂化方式是sp3杂化;
;NH3分子中N原子的价层电子对数是3+1/2(5-3)=4,所以N原子的杂化方式是sp3杂化;
(2)S与Cl比,Cl的电负性大于S,因为同周期中,随核电荷数的增加,原子吸引电子的能力增强;
(3)①用石灰石与稀盐酸反应制取二氧化碳气体,可以用如图装置,正确;②Al常温下与浓硝酸发生钝化,反应停止,所以可用Al槽车运输浓硝酸,正确;③Al的核电荷数大,原子半径小于Na,所以金属键较强,熔点高,错误;④S的非金属性比Cl弱,所以气态氢化物的稳定性比Cl弱,错误,答案选①②;
(4)使品红溶液褪色的含S化合物是二氧化硫,根据沉淀中的元素分析,含Cl:35.7%,Cu:64.3%,可知该沉淀中Cl与Cu的原子个数比是35.7/35.5:64.3/64=1:1,所以该沉淀的化学式是CuCl,所以Cu元素的化合价从+2价降低为+1价,所以硫酸铜做氧化剂,则二氧化硫是还原剂,答案选C。
考点:考查元素的推断,元素周期律的应用,电子排布图、杂化方式的判断,化学式的判断
本题难度:困难
2、选择题 下列物质中,不能发生酯化反应的是
A.酒精
B.冰醋酸
C.苯
D.甲醇(CH3OH)
参考答案:C
本题解析:能发生酯化反应的物质有醇和羧酸、无机含氧酸。
本题难度:困难
3、选择题 下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是
A.C2H4、C2H6O
B.C2H2、CH4O
C.CH2O、C2H4O2
D.C3H4、C2H4O
参考答案:A
本题解析:根据有机物燃烧通式CnHmOz+(n+m/4-z/2)O2=nCO2+m/2H2O可知,在物质的量相等的条件下,消耗的氧气和(n+m/4-z/2)有关系。要时完全燃烧时消耗氧气的量是定值,则(n+m/4-z/2)必须相等,所以选项A是正确的,答案选A。
本题难度:简单
4、选择题 下列说法正确的是
A.汽油燃烧时将全部的化学能转化为热能
B.饱和石灰水中加入一定量生石灰,所得溶液的pH增大
C.向AgCl悬浊液中加入KI溶液,白色沉淀转化为黄色沉淀,说明溶解度AgClD.向AgCl悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
参考答案:D
本题解析:
本题难度:困难
5、选择题 实现下列转化通常需要加氧化剂才能实现的是
A.NaCl→HCl
B.NaCl→Cl2
C.NaClO3→Cl2
D.Cl2→HCl
参考答案:B
本题解析:氧化剂是得到电子的,说明所给的物质应该是还原剂,化合价应该升高,A中化合价不变,B中氯元素的化合价升高,C和D中氯元素的化合价降低,所以答案选B。
本题难度:困难