1、实验题 (10分)
I、为了探究HClO的漂白性,某同学设计了如下的实验。
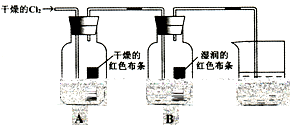
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是?。
(2)从集气瓶B中湿润的红色布条的现象可得出的结论是______________。
(3)烧杯中发生反应的化学方程式是_________________________________。
II、(1)正常雨水显酸性,其pH约值等于5.6,这是由于?。
(2)某次采集的硫酸工业产区酸雨样品,每隔一段时间测定一次pH值,得数据如下
时间
| 开始
| 8h后
| 16h后
| 24h后
| 32h后
| 40h后
| 48h后
|
pH
| 5.0
| 4.8
| 4.6
| 4.3
| 4.2
| 4.0
| 4.0
|
酸雨样品pH值变小的主要原因是_____________________________。
参考答案:(2分/空,共10分)
(1)干燥的氯气没有漂白性
(2)HClO具有漂白性(或答潮湿的Cl2具有漂白性)?
(3) Cl2+2NaOH=NaCl+NaClO+H2O
II、 (1) 显酸性的原因是 CO2+H2O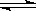 H2 CO3
H2 CO3
(2) SO2+H2O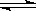 H2 SO3 ,? 2H2 SO3+ O2= 2H2 SO4(或回答SO2溶于雨水后,被不断氧化为H2 SO4)
H2 SO3 ,? 2H2 SO3+ O2= 2H2 SO4(或回答SO2溶于雨水后,被不断氧化为H2 SO4)
本题解析:I、(1)通入Cl2后,从集气瓶A中干燥的红色布条不褪色,可得出的结论是干燥的氯气没有漂白性
(2)从集气瓶B中湿润的红色布条褪色,可得出的结论是HClO具有漂白性(或答潮湿的Cl2具有漂白性)
(3)烧杯中发生反应的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O
II、(1)正常雨水显酸性,其pH约值等于5.6,这是由于二氧化碳溶于水得到碳酸的缘故。
(2)酸雨的形成主要是二氧化硫溶于水形成亚硫酸的缘故,放置酸雨一段时间,pH值变小的主要原因是亚硫酸氧化为硫酸的缘故,酸性增强,PH减弱。
本题难度:简单
2、实验题 (18分)某中学高一课外兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验。

(1)先关闭活塞a,将6.4g铜片和12 mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:关闭活塞a?;
打开活塞a?;
②B是用来收集实验中产生的气体的装置,但导管未画全,请在上图中把导管补充完整;
③实验结束后,装置C中的溶液中可能含有的溶质有?。
(2)该小组甲同学对“如何检验SO2中混有少许CO2”这个问题很感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置:

试剂:a. NaOH溶液? b. 品红溶液? c. 酸性KMnO4溶液? d. Ca(OH)2溶液
请回答:
①该同学的实验装置A中发生的化学方程式? ?。
?。
②若要达到此目的,可以在:(填所提供试剂编号)
D中加入?;E中加入?;F中加入?。
(3)事实证实,第(1)问铜片完全消失后,硫酸仍有剩余,乙同学欲测定余酸的物质的量浓度,假设反应前后溶液体积变化忽略不计,他向反应后溶液中加入含溶质a mol 的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:?mol/L(
的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:?mol/L( 用含a的代数式表达,若不能,该空不填)。
用含a的代数式表达,若不能,该空不填)。
参考答案:
(1)①Cu+2H2SO4(浓)  CuSO4+SO2?+2H2O;(2分)
CuSO4+SO2?+2H2O;(2分)
2Cu+O2+2H2SO4 2CuSO4+2H2O (2分
2CuSO4+2H2O (2分 )
)
(或分步写成:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O,也可)
②
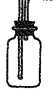 ? (2分)
? (2分)
③NaOH? Na2SO3? Na2SO4?(3分)
(2)①C+2H2SO4(浓) ?CO2?+2SO2?+2H2O?(3分)
?CO2?+2SO2?+2H2O?(3分)
②? c? b? d?(3分)
(3)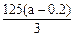 ?(3分,其余合理表达式均可)
?(3分,其余合理表达式均可)
本题解析:略
本题难度:简单
3、实验题 (5分)某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
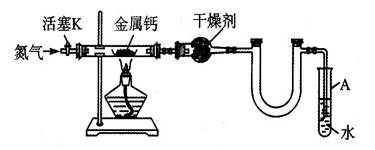
(1)按图连接好实验装置,检查装置的气密性的方法是 。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是①打开活塞K并通入N2;②点燃酒精灯,进行反应;
③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
直玻管质量m0/g
| 直玻管与钙的质量m1/g
| 直玻管与产物的质量m2/g
|
14.80
| 15.08
| 15.15
|
①计算得到实验式CaxN2,其中x= 。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
参考答案:(5分)
(1)关闭活塞K,加热直玻管,若导管口处产生气泡,停止加热后,导管中形成一段液柱,则气密性良好。
(2)防止反应过程中空气进入反应管,便于观察N2流速
(3)熄灭酒精灯,待反应管冷却至室温,停止通N2,并关闭活塞K
(4)①2.80
②x<3 O2和N2与等质量的Ca反应,生成CaO质量高于Ca3N2,导致计算出的n(N)偏大
本题解析:由于金属钙为特别活泼的金属,故在制取Ca3N2的过程中,必须保证系统中无其它杂质气体,保证气密性良好:实验前先通入氮气,再加热,实验结束时,先停止加热、冷却后再停止通氮气
(2)防止空气从装置右端进入装置内,并且通过观察气泡来控制气体流速
(4)①由所给数据可知钙的质量为:15.08-14.80=0.28g,氮元素的质量为:15.15-15.08=0.07g,则两元素的原子个数比为: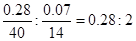 ,故x=0.28
,故x=0.28
②O2和N2与等质量的Ca反应,生成CaO质量高于Ca3N2,导致计算出的n(N)偏大,故x<3(或采用极值法来考虑:当气体全部为氧气时,得到的物质为CaO(即Ca2O2),而全部为氮气时得到的为Ca3N2,故通入的N2中混有少量O2时,所得物质的分子式中x<3)
本题难度:一般
4、选择题 下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述不正确的是

A.装置①能控制反应的发生和结束
B.若将反应后②的试管取下,在通风橱中加热,会产生刺激性气味的气体,溶液呈红色
C.③中石蕊溶液变红色
D.为确认CuSO4生成,向①中加水,观察溶液颜色
参考答案:D
本题解析:铜和浓硫酸反应生成SO2、硫酸铜和水。SO2溶于水显酸性,能使石蕊试液显红色,所以选项ABC都是正确的。D不正确,应该是把试管中的溶液倒入水中,因为试管中还含有浓硫酸,答案选D。
本题难度:简单
5、实验题 (12分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到的实现现象是___________,②反应过程中发生反应的化学方程式是???。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有FeO42-)。
Ⅱ.SCN-的电子式为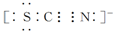
III.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为FeO42-,请写出该离子反应方程式__________。
②第二种假设是:____________,提出该假设的理论依据是___________________
?
参考答案:(1)①产生白色沉淀,迅速变为灰绿色,最终变成红褐色
②FeCl2+2NaOH===Fe(OH)2↓+2NaCl
4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)①2Fe3++3Cl2+8H2O===2FeO+6Cl-+16H+
②SCN-被Cl2氧化 从电子式分析,SCN-中S为负二价,N为负三价,均为最低价有被氧化的可能
本题解析:
本题以铁元素及其化合物的知识点为基础,考查方程式书写基本功,以及提出问题,分析问题,解决问题的能力。
⑴Fe2++2OH―=Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3 ①产生白色沉淀,迅速变为灰绿色,最终变成红褐色,②方程式这FeCl2+2NaOH===Fe(OH)2↓+2NaCl、
4Fe(OH)2+O2+2H2O===4Fe(OH)3;Cl2可将Fe3+氧化(2)①2Fe3++3Cl2+8H2O===2FeO+6Cl-+16H+ ?②SCN-被Cl2氧化 从电子式分析,SCN-中S为负二价,N为负三价,均为最低价有被氧化的可能。
本题难度:一般