1、选择题 向碘水中加入适量CCl4并振荡,静置后观察到的现象是
A.形成均匀的无色溶液
B.形成均匀的紫红色溶液
C.液体分层,下层呈紫红色
D.液体分层,上下层均呈无色
参考答案:C
本题解析:碘易溶在有机溶剂中,所以二者混合后会发生萃取,碘分子进入四氯化碳中,溶液显紫红色。由于四氯化碳的密度大于水的,所以在下层。答案选C。
本题难度:一般
2、选择题 现在MgCl2、AlCl3、CuCl2、FeCl3四种溶液只用一种试剂把它们区别开,这种试剂是
A.氨水
B.AgNO3
C.NaOH溶液
D.NaCl
参考答案:C
本题解析:必须添加了这一种试剂出现不同现象,就可区分开。由于CuCl2溶液浓度很大时候是绿色,浓度低时是蓝色铜盐溶液呈蓝色,FeCl3溶液呈黄色或浅黄色。MgCl2、AlCl3可用NaOH溶液区分,前者生成白色沉淀不溶解。后者加入NaOH溶液至过量会出现白色沉淀后又溶解的现象。当然CuCl2溶液和FeCl3溶液区分也可用NaOH溶液,根据生成的氢氧化物的颜色区分就更明显。
点评:鉴别离子的方法,一般是先用物理性质区分,再用化学性质区分。
本题难度:一般
3、选择题 一定质量的某硝酸钾样品中不含可溶性杂质,在10℃时加一定量蒸馏水使之充分溶解,残留固体的质量为250g,若升温至40℃,残留固体的质量为120g;升温至70℃,残留固体的质量为20g.已知KNO3在不同温度下的溶解度:
A.该硝酸钾样品一定为纯净物
B.40℃时溶于水的硝酸钾为130g
C.70℃硝酸钾溶液为饱和溶液
D.55℃左右时硝酸钾完全溶解
参考答案:D
本题解析:分析:根据硝酸钾不同温度下的溶解度差值,利用已知温度段10℃到40℃的硝酸钾的溶解量增加值计算温度段40℃到70℃的溶解度增加值,与题目中实际增加值比较,可知道70℃硝酸钾溶液还未达到饱和,存在杂质,杂质质量为20g,通过40℃到55℃溶解度增加值,算出55℃左右硝酸钾恰好完全溶解.
解答:A.从10℃到40℃,硝酸钾溶解度增大了45g,溶解的硝酸钾增加了250-120=130 g,从40℃到70℃,硝酸钾的溶解度增大了140g-65g=75g,
硝酸钾达到饱和需要的溶解量为130÷45×75=216.67g,溶解的硝酸钾增加了120-20=100 g,小于216.67g,说明硝酸钾已经溶解完毕,残余固体为杂质,故A错误;
B.从10℃到40℃,溶解的硝酸钾增加了250-120=130 g,10℃时已有部分硝酸钾溶解,故40℃时溶于水的硝酸钾为大于130g,故B错误;
C.从A选项分析可以知道,70℃时硝酸钾达到饱和需要多加216.67-100=116.7g硝酸钾,故此时不为饱和溶液,故C错误;
D.从10℃到40℃,硝酸钾溶解度增大了45,溶解的硝酸钾增加了250-120=130 g,从40℃到55℃,硝酸钾的溶解度增大了100-65=35,硝酸钾达到饱和需要的溶解量130÷45×35=101.11g,近似等于120-20=100g,故从10℃到40℃,硝酸钾溶解度增大了45,溶解的硝酸钾增加了250-120=130 g,从40℃到70℃,硝酸钾的溶解度增大了140-65=75,硝酸钾达到饱和需要的溶解量,D正确;
故选D.
点评:本题考查了硝酸钾在不同温度下的溶解度,根据溶解度差值计算增加的硝酸钾质量,判断硝酸钾是否饱和、什么时候溶解完全、是否含有杂质等即可解答.
本题难度:简单
4、选择题 实验是化学研究的基础。下列关于各实验装置的叙述正确的是(? )
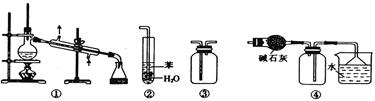
A.装置③可用于收集H2、CO2、Cl2、NH3等气体
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置①常用于分离互不相溶的液体混合物
D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
参考答案:A
本题解析:A、装置③长导管进气适用于收集密度大于空气的气体,短导管进气适用于密度小于空气的气体,正确;B、导管深入到水中,NH3和HCl会引起倒吸,错误;C、装置①常用于分离互相溶解、沸点不同的液体混合物,错误;D、装置④可用于收集密度小于空气的气体,HCl密度大于空气,错误。
本题难度:一般
5、选择题 NA表示阿伏加德罗常数的值,下列说法中正确的是
A.2L0.5mol?L-1的NH4Cl溶液中含有NA个NH4+
B.18g?D2O中含有10NA个电子
C.1molNa2O2与足量的水反应生成O2转移NA个电子
D.32gO2和O3的混合物中含有的原子总数一定是2NA个
参考答案:CD
本题解析:分析:A.NH4+水解;
B.根据n=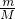 =
=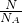 结合原子的构成判断;
结合原子的构成判断;
C.根据反应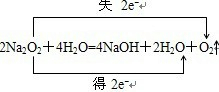 判断;
判断;
D.32gO2和O3的混合物组成原子都为O,根据n=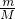 =
=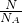 计算.
计算.
解答:A.NH4+水解,2L0.5mol?L-1的NH4Cl溶液中NH4+的个数小于NA,故A错误;
B.n=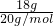 =0.9mol,则18gD2O中含有9NA个电子,故B错误;
=0.9mol,则18gD2O中含有9NA个电子,故B错误;
C.由反应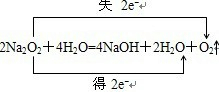 可知,1molNa2O2与足量的水反应生成O2转移NA个电子,故C正确;
可知,1molNa2O2与足量的水反应生成O2转移NA个电子,故C正确;
D.32gO2和O3的混合物组成原子都为O,n(O)=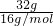 =2mol,则原子总数一定是2NA个,故D正确.
=2mol,则原子总数一定是2NA个,故D正确.
故选CD.
点评:本题考查阿伏加德罗常数,题目难度不大,本题注意物质的性质、原子结构和组成等问题,为该题的主要考查点,也是易错点.
本题难度:一般