1、选择题 下列化学用语和描述均正确的是(?)
A.结构示意图为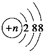 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
B.球棍模型为: 的分子可发生加成反应
的分子可发生加成反应
C.符号为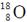 的原子常用于文物年代的测定
的原子常用于文物年代的测定
D.电子式分别为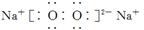 和
和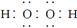 的两种化合物均为常见的氧化剂
的两种化合物均为常见的氧化剂
参考答案:D
本题解析:A不正确,例如硫离子水解促进水的电离。B中应该是比例模型,不正确。用于文物年代的测定是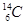 ,所以正确的答案选D。
,所以正确的答案选D。
本题难度:一般
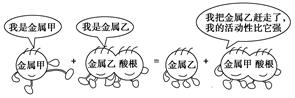
2、选择题 下列反应中符合该卡通情境的是( )
A.C+2CuO2Cu+CO2↑
B.Cu+2AgNO3===Cu(NO3)2+2Ag
C.Fe2O3+3CO2Fe+3CO2
D.BaCl2+Na2SO4===BaSO4↓+2NaCl
参考答案:B
本题解析:根据图像可知该反应为金属间的置换反应,所以符合的是B。答案选B。
点评:根据反应的特点进行准确的判断,比较简单基础。
本题难度:一般
3、选择题 下列生产、生活中的事例不属于氧化还原反应的是
A.铝的表面生成致密的薄膜
B.大理石雕像被酸雨腐蚀毁坏
C.食物腐败
D.钠在空气中燃烧
参考答案:B
本题解析:凡是有元素化合价升降的反应的是氧化还原反应,因此ACD的是氧化还原反应。大理石被酸雨腐蚀属于复分解反应,不是氧化还原反应,答案选B。
本题难度:一般
4、填空题 (10分)为了测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amol/L的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为: 2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
试回答:
①实验中,需要的仪器有(填序号) ,还缺少的仪器有(填名称)
A托盘天平(带砝码、镊子) B滴定管 C 100mL的量筒 D、100mL的容量瓶
E、烧杯 F、漏斗 G、锥形瓶 H、玻璃棒 I、药匙 J、烧瓶
②实验中,标准KMnO4溶液应装在 式滴定管中,因为
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会 (填偏大、偏小、无影响)。
④在滴定过程中若用去amol/L的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol/L,由此,x= 。
⑤若滴定终点读数时俯视刻度,则计算的x值会 (填偏大、偏小、无影响)。
参考答案:①A、B、D、E、G、H、I ,胶头滴管、铁架台带滴定管夹 ;
②酸 ,KMnO4溶液有腐蚀性,会腐蚀橡胶;③无影响
④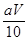 , x=
, x=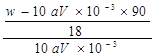 或者
或者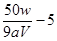 ;⑤ 偏大 。
;⑤ 偏大 。
本题解析:①根据配制溶液需要的仪器可知:在该实验中,需要的仪器有A、B、D、E、G、H、I ,还缺少的仪器有胶头滴管、铁架台带滴定管夹;②实验中,标准KMnO4溶液因为有强氧化性,会腐蚀橡胶管,所以应该应装在酸式滴定管中,③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,因为锥形瓶中物质的质量等都没有变化,所以则所测得的x的值会无任何影响;④根据反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知:n(H2C2O4)= 5/2n(KMnO4) 。n(KMnO4)= aV×10-3mol,0.025L×c(H2C2O4)= 5/2×aV×10-3,解得c(H2C2O4)=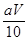 mol/L。则[Wg÷(90+18x)g/mol]÷4=
mol/L。则[Wg÷(90+18x)g/mol]÷4=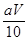 ×0.025mol,解得x=
×0.025mol,解得x=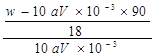 或者
或者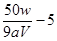 ;⑤若滴定终点读数时俯视刻度,则草酸的物质的量偏少,计算的x值会偏大。
;⑤若滴定终点读数时俯视刻度,则草酸的物质的量偏少,计算的x值会偏大。
考点:考查物质的量浓度的溶液的配制、滴定法在测定物质的浓度积物质组成中的应用的知识。
本题难度:一般
5、选择题 在100mL含等物质的量的HBr和H2SO3的溶液里通入0.025mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3?).则原溶液中HBr和H2SO3的浓度都等于( )
A.0.25mol?L-1
B.0.002mol?L-1
C.0.02mol?L-1
D.0.2mol?L-1
参考答案:还原性H2SO3>HBr,通入的氯气先氧化H2SO3为H2SO4,H2SO3反应完毕,剩余的氯气再氧化HBr为Br2.令原溶液中HBr和H2SO3的浓度都为cmol/L,根据电子转移守恒有cmol/L×0.1L×(6-4)+cmol/L×0.1L×1×12=0.025mol×2,解得c=0.2.
故选:D.
本题解析:
本题难度:一般